Физические свойства газов и законы газового состояния
Глава II
ФИЗИЧЕСКИЕ СВОЙСТВА ГАЗОВ И ЗАКОНЫ ГАЗОВОГО
СОСТОЯНИЯ
Природные газы представляют собой физическую смесь отдельных компонентов, химически не действующих друг на друга. Поэтому при обработке этих газов к ним применимы основные законы физики и термодинамики с известными отклонениями, о которых будет сказано ниже.
Свойства природных газов предопределяются их составом, следовательно, если знать, какие компоненты входят в состав газа, можно определить его физические свойства.
Известны различные методы анализов газа для определения тех или иных компонентов его. С02, H2S, 02, СО определяются поглощением различными растворами (щелочь, щелочный раствор пирогаллола и др.), а углеводородные компоненты определяются сожжением. Однако, этот способ может дать только общее, суммарное количество углеводородов, что часто является недостаточным при решении вопроса о направлении использования газа.
В таких случаях следует произвести разделение отдельных углеводородов и определить их количество в смеси. Разгонку углеводородных газов на отдельные компоненты достаточно точно можно произвести на приборах В. А. Соколова и В. Подбельняка.
В последнее время в США предложен новый метод количественного определения углеводородных газов в смеси — спектроскопический, обеспечивающий надежные результаты и в значительно более короткое время, чем на фракционирующих аппаратах.
При решении практических вопросов использования газа и, в частности, вопроса об отбензинивании его, требуется определить количество тяжелых газо-бензиновых углеводородов в нем. В этом случае пользуются данными полного анализа газа или производят специальное определение содержания тяжелых фракций в газе одним из трех методов: компрессией и охлаждением испытуемого газа, поглощением жидкими поглотителями, такими, как керосин, соляровое масло и др., или поглощением активированным углем. Последний следует считать более надежным и применимым как для сухих, так и для жирных газов.
Физическое состояние газа определяется тремя величинами: объёмом, давлением и температурой. В зависимости от давления и температуры изменяется и объём газа. Чтобы иметь правильное представление о количестве газа, необходимо приводить его объём к стандартным условиям, т. е. к стандартной температуре и давлению. В США во всех термодинамических расчетах за стандартные условия приняты: температура 32° F (0° С) и давление 14,695 фунт/дм2 (760 мм рт. ст.) в газовой же промышленности стандартными условиями приняты: температура 60° F (15,56° С) и давление 14,65 фунт/дм2 (757,5 мм).
В СССР стандартными условиями считаются темпеоатура 0° С и давление 760 мм рт. ст.; в газовой промышленности принимают температуру 20° С и давление 760 мм рт. ст.
Основными физическими свойствами углеводородных газов являются:
1) молекулярный вес;
2) удельный вес в газообразном состоянии;
3) удельный вес в жидком состоянии;
4) теплоёмкость;
5) упругость паров;
6) температуры кипения и плавления;
7) критические температура и давление;
8) скрытая теплота испарения;
9) количество паров из единицы объёма жидкости.
Эти параметры характеризуют особенность и свойства каждого газа и жидкости. Знание их чрезвычайно важно при решении всякого рода задач, связанных с добычей, транспортом, переработкой и использованием газа.
Молекулярный вес какого-либо вещества представляет сумму весов атомов, входящих в молекулу. Например, молекулярный вес метана (СН4) равен (1 xl2)-f(4х 1,01) = 16,04.
хМолекулярный вес, выраженный в килограммах, называется килограмм-молекулой, или молем. Объём моля для всех газов при температуре 0° С и атмосферном давлении одинаков и равен 22,412 м3.
Молекулярные веса пропорциональны удельным весам того же вещества. Состав газовых смесей выражают в весовых и в объёмных процентах. Состав жидких смесей выражают в весовых, объёмных и в молекулярных процентах. Для газов объёмные и молекулярные проценты одинаковы. Если объёмные (молекулярные)проценты требуется перевести в весовые, то молекулярный процент каждого компонента умножают на молекулярный вес этого компонента, и получают вес его. Затем суммируют вес всех компонентов и определяют проценты каждого компонента в смеси. Наоборот, если требуется весовые проценты перевести в объёмные? нужно каждый весовой процент компонента разделить на его молекулярный вес, суммировать полученные моли компонентов и определить молекулярный или объёмный пррцент каждого.
Удельный вес газа. Вес 1 мъ газа при 0° С и атмосфер-* ном давлении называется удельным весом газа (измеряется в кг/м3). Относительный удельный вес газа есть отношение веса единицы объёма газа к весу такой же единицы объёма воздуха при одинаковых условиях температуры и давления.
Чем жирнее газ, тем больше его удельный вес.
Однако на основании одного удельного веса можно сделать самое общее предположение о жирности газа, имея в виду, что присутствие в газе углекислоты, азота и пр. может явиться причиной ошибочного вывода. В таких случаях следует проверить газ на содержание в нем газобензина одним из ранее упомянутых методов.
Удельный вес естественных газов по воздуху колеблется в пределах от 0,58 до 1,6, причем нижний предел относится к газам, главным образом состоящим из метана, верхний — характерен для жирных нефтяных газов. Определить численное значение удельного веса газа возможно двумя методами:
а) непосредственным измерением или
б) вычислением на основе известного состава газа.
Для непосредственного измерения существует несколько различных способов и приборов, причем наиболее точным считается способ взвешивания. По этому способу определение удельного веса газа ведут следующим образом. Берут баллон или колбу, откачивают из нее воздух масляным или ртутным насосом и взвешивают на аналитических весах. Затем взвешивают ту же колбу поочередно с воздухом и газом. Вычитая из веса баллона с газом или воздухом вес пустого баллона, узнают веса чистого газа и воздуха. Делением веса газа на вес воздуха находят удельный вес газа по отношению к воздуху.
Имеются более простые, но вместе с тем и менее точные способы определения удельного веса газа, основанные на методе истечения. В лабораторной практике пользуются распространением прибор Шилинга и прибор Бюро стандартов. На этих приборах определенный объём газа и воздуха пропускается через узкое отверстие в диафрагме и замечается время истечения этого объёма. Удельный вес газа находится из соотношения
![]()
где d—удельный вес газа;
7\ — время истечения газа;
Т2 — время истечения такого же объёма воздуха.
Если известен состав газа по отдельным компонентам, то легко вычислить удельный вес газа, зная удельные веса компонентов. Допустим, мы имеем газ следующего состава в объёмных процентах:
100
Требуется определить удельный вес этого газа. Это легко сделать путем умножения удельного веса каждого компонента на содержание его в газе и сложения полученных произведений, т. е.
Метан ....... ....0,5538.0,90 =0,4984
Этан.................1 0381. 0,02 =0,2076
Пропан...........I 5222. 0,015=0,0228
Бутан ........... 2 0065.0,012=0,0250
Пентан и более тяжелые . . . 2,5100.0,008=0,0200
Углекислота ........I 5194. О 015=0,0226
Азот ................0,9672 . 0,03 =0,0290
0,8254
Таким образом, удельный вес газа по отношению к воздуху будет
0,8254.
Теплоёмкость или удельная теплота измеряется количеством тепла, потребным для нагревания единицы веса или объёма этого вещества на ГС. Для газов она бывает весовой, измеряемой в ккал/кг и объёмной — ккал/м3.
При нагревании газа возможны два случая:
1. Газ находится в свободно расширяющемся сосуде.
По мере нагревания газа объём его расширяется (давление в сосуде остается постоянным), а поглощаемая им теплота расходуется на повышение температуры и на производство внешней работы. Теплоёмкость газа при этом Ср.
2. Газ находится в сосуде постоянного объёма. По мере нагревания температура и давление газа возрастают. Так как объём остается постоянным, то газ никакой работы не совершает, и тепло тратится только на повышение температуры. Теплоёмкость газа в этом случае будет Cv.
Легко понять, что Ср больше Cv на величину внешней работыг которую обозначим через R. Если тепловой эквивалент работы обозначить через А, то можно написать следующее равенство:
Ср — Су = AR
В технике очень важным является отношение теплоёмкостей Ср к Cv.
Теплоёмкости Ср и Cv зависят от температуры: с возрастанием ее теплоёмкость также возрастает. Теплоёмкость Cv возрастает быстрее, чем Ср, и поэтому отношение их с возрастанием температуры убывает.
Объёмная теплоёмкость определяется по весовой из соотношения:
CJ = ~--C„ (2)
И
(3)
Для смеси газов теплоёмкость определяется по процентному составу газа и теплоёмкости компонентов, входящих в данную смесь.
Т еплопроизводительность, или теплотворная способность определяется тем количеством тепла, которое выделяется при сжигании единицы веса или единицы объёма вещества и измеряется в калориях.
Для газа теплопроизводительность измеряется в ккал/кг и в ккал/м3 „ Эта величина весьма существенна при оценке газа как топлива. Следует отличать низшую теплопроизводительность от высшей; низшая меньше высшей на то количество тепла, которое идет на парообразование воды, заключающейся в продуктах горения.
На практике приходится иметь дело с низшей теплотворной способностью. Теплопроизводительность естественных газов изменяется от 7500 до 12 ООО ккал/м3. Сухие газы имеют меньшую калорийность на ж3, чем жирные газы, но более высокую на кг.
Для смеси газов теплотворную способность можно вычислить, исходя из состава газа и теплотворной способности его компонентов.
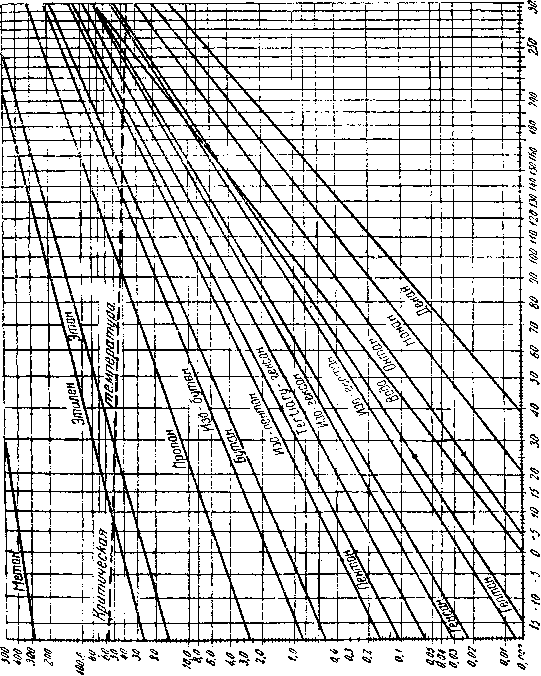
Упругость паров углеводородов измеряется в мм рт. столба или в кг/см2. Этот параметр имеет большое значение при извлечении газо-бензиновых фракций, а также при хранении и транспорте газобен-зина и жидких газов. Упругость паров отдельных углеводородов в зависимости от температуры приведена на диаграмме (фиг. 1).
-??D г^2/ду
о
П
О
Ю
<L>
п
>*
СО
о
CS
С
Л
$
Упругость для каждого углеводорода различна, причем, чем тяжелее углеводород, тем упругость его меньше. При одновременном нахождении газа и жидкости в ёмкости, трапе или сепараторе разделение на газовую и жидкую фазы происходит в соответствии с упругостью каждого компонента таким образом, что парциальные давления в газе и жидкости для одного и того же компонента будут равны.
Заранее можно сказать, что легких углеводородов (метан, этан, пропан), имеющих высокую упругость паров, в газе будет сравнительно
сл д ц? а а; д д. д.
!°? ?о § я
* я
3 “
Н ра
^05 Я о о 5
to О
о тз чз о
О 5=>
>Н
Р о
я to
5 ° J? to
<Ъ
о
я W
S о
О Н
e-w
? я
cu fD
’g'S
E я
DO 2
]э E E S4
Г’ <тз
' fca
я g
to я Л из Ж я
л> а> я я ч о
{15 {U
я я
w о о я
Раздел I. Природные газы и их свойства
(Молекулярный вес
Отношение веса углерода к весу водорода
Температура плавления в °С при 760 мм рт. ст.
Температура кипения в °С при 760 мм рт. ст.
Критическое давление в кг/см2
| о 5е | |
It» ЪР | хп со*Р | 8? | ОЭС |
ОО У? | ро II |
ОО *1?-1йГ I | ОО |
ОО II | оо II | op II | pn II | OO |
| 0 1 | м (в | о ос |
о» | M to | to в | © * | |||||||
|
28,966 94,108 S | 64,06 18,016 | 44,01 34,07 |
to to 00 00 оо "** 3 | 2,016 32,000 | 92,134 I 26,036 | 42,079 1 78,108 | 142,278 28,052 |
114,226 128,252 | 86,173 100,199 |
72,14? 72,147 | 58,121 72,147 | 44,095 58,121 | 16,042 30,069 |
| 1 1 | 1 1 | 1 1 | I 1 |
1 1 | 10,43 11,91 |
5,96: 11,91 | след coV оз to |
5,30 5,36 | 5,11 5,21 | 4.96 4.96 | 4s- 4^ "со "-a 03 о | 4,46 4,76 | i 2,98 3,97 |
|
+ | 1 | 1 | —209,8 -207,0 | 1 1 to to — сл оо <о V — | 1 1 |
+ | | 1 1 | 1 1 | 1 i | 1 1 | I i | i i | 1 1 |
| ^ 1 to 1 сл | О <1 Ю <1 | 85,5 |
?§; о — | 184,9 5,5 |
29,7 169,2 | 56,8 53,7 |
95,5 90,8 | 160,6 16,6 | 145,4 129,7 | [87,2 139,0 | [82,5 183,2 | ||
| 1 1 ?? % со | 1 О о о | — 78,5 — 60,4 | —195,8 — 192,0 |
1 1 — to SE3 Ъ'*-4 |
1 + оо •— 4^0 1о сл | + 1 8й 00 | + 174 -103,7 |
±± сл to о сл Vi сз оо to | + + to оз оо оо t* | + + to to 00 сл |
- 12,22 + 36,11 | | - 41,11 - 0,5 | -161,13 - 89 |
|
38,5 | 86,8 225,6 |
75,6 92,2 | 34.59! 36,2 |
1 13,22 | 51,32 | 42,95 64,04 | 46,96 49,21 | 21,94 52,65 | 25,38 23,69 |
30,52! 27,911 | 33,89 34,1 |
38,25 34,1 | 43,38 38,74 |
47,32 49,78 |
04 0> *-j "O to О <T> со я о я
^ 2 о to чз о о г» § *
? я
о\*о
о
| I 1 § | 218,3 374,1 | о оо оТ— | оЗ ? СО | -239,9 -118,8 | со 00 to О) о ОО) | to 00 со оо Сл Ъя О) |
со 00 -4 4ь-Ю О» | оо to to О to Oi | j 234,78 267 | 187,78 i S 183,89 | 134 ! 197,2 |
96,78 152 | + 1 00 00 to ^о to oi 00 | Критическая температура в °С |
| г* ° о оо 2S | 1,460 0,999 |
1,56 0,790 | О о gg — 00 | 0,071 1,140 |
о ! 23 о |
'11 to | 0,734 (0 4) |
о о V.1 <1 to о to -4 | 0,664 0,688 | 0,625 0,598 |
0,564 0,631 | 0,509 0,584 | |
оо | Вес 1 л в жидком виде в кг при 760 мм рт. ст. и 15,56° С |
| о = 1 СЛ | ! 1 | I 1 | 1 1 | 1 1 | 0,0094 | 0,012 0,0113 | 0,0052 0,014 |
0,0062 0,0056 | | 0,0077 I 0,0069 | 0,0087 0,0083 | оо о о о о 00 «о -4 | 0,0115 0,0106 | 0,019 0,013 |
Грамм-молекул в 1 мм жидкости и при 760 мм рт. ст. и 15,56° С |
|
1,223 3,973 1 | 2,705 0,761 | Voo со и< оо оо | 1,183 ! 1,001 | 0,085 1,351 | 3,890 1,099 |
! 1,777 3,298 | 6,007 I 1,184 | 4,823 5,415 | 4^ 00 rob) оо оо Н- 00 | 1 3,046 , 3,046 I | 2.454 3,046 |
1,862 2,454 | 0,677 1,270 |
Вес 1 л*3 газа в кг при 760 мм рт. ст. и 15,56° С |
|
0,818 0,252 | 0,369 1,316 |
0,538 0,695 | 0,847 0,999 | 11,78 0,781 |
0,257 0,913 | 0.564 0,304 |
0 167 0,847 | 0,207 0,185 | 0,275 0,236 | 0 329 0,329 | о о 00-? to о СО | 0,537 : 0,407 i | 1,474 0,787 | Объем 1 кг газа в мъ при 760 мм рт. ст. и 15,56° С |
| 1,0000 3,2488 ! 1 |
2,2122 0,6220 | 1,5194 1,1763 | 0 9672 0,9670 |
0,0696 1,1048 | 3,1807 I 0,8989 I | 1,4527 2,6966 | 4,9119 0,9684 | 4^ 00 4^ СО to -4 ОО 05 сл | 2,9749 3,4592 |
2.4908 2.4908 | 1 2,0065 2,4908 | 1.5222 2,0065 | 0,5538 10381 | Уд. вес газа по отношению к воздуху при 760 лшрт.ст. и 15,56° С |
| 187,8 | 1312,1 |
548,2 | 1 1 | | 1 | 223,2 | 283,5 266,9 | 121,9 333,7 |
146,3 133 | 182 1623 |
! 204,6 195,93 | 229,4 206,6 | 272,9 237,5 | 442.1 311.1 | Кубических метров газа из 1 мъ жидкости при 760 мм рт. ст. и 15,56° С |
| 1,00039 |
I'i to о СЛ со |
1,0058 1,0110 | 1,0003 1,0012 | ! 0,9993 1,00075 | 1,040 | ! 1,013 1,030 | 1,140 1006 | 1.100 1,120 | 1 065 1.087 | 1,045 | 1,030 1,048 | 1016 1,032 |
1.002 1,008 | Индекс отклонения газа от закона Бойля при 760 мм рт. ст. и 15,56° С RT и —- ри |
Глава II. Физические свойства газов и законы газового состояния
| О, О с о с « г | Наименование компонентов | Химиче ская формула |
Уд. тепло< 760 мм рт. ДЛЯ Газ | емкость при |
Тепло | |||
| СТ. И U 1 кг | Жид кость | Калорий из 1 кг газа или пара | ||||||
|
cv | 1 |
ср | высшая |
к 00 3 к X |
||||
| 1 | Метан........ |
СН4 | 0,530 |
0,405 | 1,309 |
13290 | 11 967 | |
|
2 | Этан........ |
с2нв | 0,415 |
0,346 | 1,198 |
— | 12418 | И 362 |
| 3 | Пропан . ...... | с3н8 |
0,376 | 0,324 | 1,161 |
_ | 12 051 | 11090 |
| 4 | н-бутан ....... | с4н10 |
0,357 | 0,312 | 1,144 | 0,55 | 11 856 | 10 945 |
| 5 |
Изо-бутан...... |
с4н10 | 0 357 |
0,312 | 1.144 | 0,55 | 11829 | 10917 |
| 6 | tf-пентан ....... |
с5н12 | 0,347 | 0,309 | 1,121 |
0,64 | 11 734 | 10 856 |
| 7 | Изо-пентан ..... | с5н12 |
_ | _ | _ |
0,53 | 11 701 | 10817 |
| 8 | 2,2-диметил пропан . | с5н12 ¦ | — | — |
— | — | 11 662 |
10 778 |
| 9 |
н-гексан....... | СвНц | 0,339 | 0,305 |
1,113 | 0,536 | 11651 |
10 790 |
| 10 |
«•гептан ....... |
с7н16 | 0,335 |
0.302 | 1,109 | 0,529 | 11 599 | 10 745 |
| 11 | н-Октан ...... |
с8н18 | 0,330 | 0,300 | 1.100 |
0,517 | 11 545 | 10 706 |
| 12 |
н-нонан....... | СдН20 |
0,327 | 0,299 | 1^093 | 0,518 | 11506 |
10 678 |
| 13 |
н-декан ....... | CjqH 22 |
0,323 | 0,298 | 1,084 |
0,517 | 11479 | 10 656 |
| 14 | Этилен ....... | С2Н4 |
.0,362 | 0,288 | 1,258 | — | 12 029 | i 11 278 |
| 15 |
Пропилен ..... |
С3Н6 | 0,351 |
0,298 | 1,180 | _ |
11 701 | 10 945 |
|
16 | Бензол ....... |
С6Н€ | 0,256 |
— | — | 0.414 | 10 126 | 9717 |
| 17 | Толуол ....... |
С7Н8 | _ |
_ | _ | 0,397 |
10 262 | 9 801 |
|
18 | Ацетилен...... |
С2н2 | 0,407 |
0,321 | 1,269 | — |
11 990 | 11 584 |
| 19 | Водород ...... |
н | 3,4 | 2,42 |
1,41 | _ | 33 915 | 23 624 |
| 20 |
Кислород ..... | о2 | 0,218 | 0,155 |
1,401 | — | — |
— |
| 21 |
Азот........ | N2 |
0,248 | 0,176 | 1,404 |
_ | _ | _ |
| 22 | Окись углерода . . . | со | 0,248 |
0,176 | 1,404 | — | 2418 | — |
| 23 | Углекислота .... |
со2 | 0,199 |
0,153 | 1,304 | _ |
_ | _ |
|
24 | Сероводород ... |
H2S | 0,254 |
0,192 | 1,320 | — |
4 156 | 3 845 |
|
25 | Сернистый газ ... . |
so2 | 0,152 |
0,118 | 1,390 | _ |
__ | _ |
|
26 | Пары воды ..... |
н2о | 0,458 |
0,343 | 1,335 | 1,000 |
— | — |
|
27 | Воздух ....... | _ | 0,241 | 0,171 |
1,410 | _ | — |
— |
| 28 |
Фенол ....... |
с6н5он | — |
— | — | — | ||
Продолжение
| производительность |
я ? * 5 <и S | те Я | Количество воздуха, | Г раница воспламеняемости с воздухом в объемных °/о | Октановое | |||||||
| Калорий из | Калорий из 1 л жидкости |
«з н Я -о к Я | во со « | нужное для горения | я |
число | ||||||
| 1 м или | idda пара |
СЗ о к О н И ^ е 2м | cfl О н § Н § Л | СП 1 о о Ю (О * — S ~ D, И ^ и »' ° ^ о | Л «в S * S с | я сг РЗ а. | S | сЪ ? | ||||
| я 3 о |
сз 3 (Г) | к сз 3 О | к са 3 го | Я 5 в ^ и “ ° S Я-ЁЛ | So Н «О в121" | X! * S t( й 5 го СП « ? 2 3" с® Я со ю а ц |
ш се 3 | к РЗ 3 о j3 | -в- «и СХ О * «и я | § ’ сх о о ^ S О 1 Н | с о сб О) м О) К-о О ? | |
| 3 I» |
Я | ВО | Я | и с а | U с |
s Stf С( Н | Stf сх— |
я | во | S |
Я ? | |
| 8 997 15 751 | 8 098 14416 | _ 4 918 | 4 497 | 136 117 | 14,0 22,7 | 17,2 16,06 | 9,53 16,67 |
5,0 3,22 | 15,0 12,45 |
— | 100-}-100 + | - |
| 22 425 29 064 | 20 637 26 821 | 6 120 6 901 | 5 629 6 367 |
100 92,2 | 19,1 18,0 |
15,65 15,43 | 23,82 30,97 | 2,37 1,86 | 9,5 8,41 | _ | 99.5 90.5 | — |
| 9 020 5 738 | 26 786 33 051 | 6 340 7 370 |
6139 6 812 | 87,8 85,0 |
27,7 | 15,43 15,30 |
30,97 38,11 | 1,80 1,40 |
8,44 7,80 | 1,3577 |
97,0 61 | — |
|
35 631 35 507 | 32 944 32 828 |
7 283 | 6 766 | 81,1 75,6 | 16,89 | 15.30 15.30 | 38.11 38.11 |
1,32 | _ | 1,3540 1,3390 | 89 | - |
| 42 377 49 015 | 39 243 44327 | 7 700 7 939 | 7 126 7 355 |
81,1 76,7 | 36.1 33.1 | 15,21 15,15 | 45,26 52,41 | 1,25 1,00 |
6,9 6,00 | 1,3750 1,3878 |
25 0 | 0 |
| 55 654 62 293 | 50 521 56 697 |
8126 8 274 | 7 535 7 675 |
72,8 69,4 | 43,2 41,1 |
15,10 15,06 | 59,55 66,70 | 0,95 0,83 | - |
1,3976 1,4056 | — 17 -28 | - |
| 68 923 14 247 | 62 891 13 348 | 8 394 4 752 |
7 795 4 451 | 66,7 115,6 |
48,3 28,5 | 15,04 14,76 | 73,85 14,29 | 0,67 2,75 | 28,60 | 1,4120 |
—53 | 100 |
|
20 779 33 371 | 19435 32 036 | 5 879 8 900 | 5 497 8537 | 105 94,4 | 17,2 30,5 |
14,76 13,25 | 21,44 35,70 |
2,00 1,41 | 11,10 6,75 | 1,5012 | _ |
100 |
| 39 867 13250 |
38 088 12 805 | 8 899 | 8 496 | 86,7 164,4 | 17,2 |
13,35 13,25 | 42,88 11,91 | 1,27 2,5 |
6,75 80,0 | 1,4969 | ||
| 2 883 | 2 429 | — | _ |
107,8 | 15,2 | 34,23 |
2,38 | 4,0 | 74,2 | _ | __ | — |
| — |
— | 51,1 | 3,3 |
— | — | — | — | — |
— | — | ||
| 2 856 | — | - |
- | 47,8 50,5 | 6,1 8,0 | 24,63 | 2,38 |
12,5 | 74,2 | - | - | — |
|
5 980 | 1 5 526 | — | 131,1 |
45,3 16,6 | 6,07 |
7,15 | 4,3 | 45,5 |
— | — | ||
| - | __ | — |
_ | 538,9 | 79,4 | — | _ | _ | — | 1,333 |
— | — |
|
¦ | - | 8 473 |
7 983 | |||||||||
Gas Journal", 1942, т. 41, № стр. 33. Американские меры перечислены
больше, чем в жидкости и, наоборот, более тяжелых углеводородов в газе будет меньше, чем в жидкости.
Основные свойства углеводородных газов и паров приведены в табл. 3.
В табл. 4 дана скрытая теплота испарения для разных углеводородов в зависимости от давления.
Таблица 4
Скрытая теплота испарения углеводородов в зависимости от давления, кал/кг
|
Давление, ата |
Метан | Этан |
Пропан | Бутан |
Изобутан | Пентан |
Гексан |
| 1.0 |
136 | 114 | 106 |
92 | 89 | 83,5 |
79 |
| 2,0 |
115 | 109 | 89 |
85 | 82 | 78 |
74 |
| 5,0 | 111 | 103 | 89 |
77,5 | 73,5 | 68,5 |
65 |
| 10,0 |
103 | 94 | 78 |
68 | 65,5 | 60 |
55,5 |
| 15,0 |
97 | 83,5 | 68,5 |
58,5 | 56 | 52 |
48 |
| 20,0 |
92 | 78 | 64 |
53 | 50 | 45 |
40 |
| 25,0 | 84 | 68 | 56 | 44,5 | 40,5 | 33,4 |
22,2 |
| 30,0 | 76 | 65,5 | 46,5 |
31 | 31 | 17,8 |
__ |
ЗАКОН БОЙЛЯ-МАРИОТТА
В 1662 г. английский физик и химик Роберт Бойль установил закон сжатия газов, который гласит: при постоянной температуре объёмы газа обратно пропорциональны его давлению.
В 1676 г. этот закон был экспериментально проверен французским аббатом Мариоттом, и с тех пор закон сжатия газов назван по имени обоих исследователей.
Если обозначить через иг и гь объёмы, занимаемые газом, а через Pi и Рг —соответствующие давления, то по закону Бойля-Мариотта
1>1 _ Р‘г
v2 Pi ’
или
vxpx = v.,p% — V7 Р — const, (4)
т. е. произведение давления на объём для данной температуры газа есть величина постоянная.
Так как удельные объёмы газа равны обратной величине удельных весов, т. е.
Vl = V2
V 2 У1
то
Pi _ п_
Рг У 2 '
ЗАКОН ГЕЙ-ЛЮССАКА
Если закон Бойля-Мариотта дает зависимость объёмов газа от различных давлений при постоянной температуре, то закон Гей-Люссака устанавливает зависимость между объёмом газов и температурой при постоянном давлении и читается так: увеличение объёма газа при постоянном давлении прямо пропорционально его абсолютным температурам, т. е.
![]()
или, заменяя удельные объёмы через удельные веса, получим:
![]()
или
Опытным путем над различными газами при постоянном давлении установлено, что при нагревании газа на 1° С объём его увеличивается на 1/273 от его объёма при 0° С. При охлаждении газа на 1° С объём соответственно уменьшится.
ХАРАКТЕРИСТИЧЕСКОЕ УРАВНЕНИЕ ГАЗОВ
Сопоставляя законы Бойля-Мариотта и Гей-Люссака, можно получить уравнение, которое связывает три переменных величины:
Р, V и Т.
Это уравнение имеет вид:
или, обозначая постоянную величину через R, получим для 1 кг газа
PV=RT.
(6)
Для G кг газа уравнение будет:
PV =GRT.
(7)
Постоянная R называется газовой постоянной; для разных газов она различна. Газовую постоянную можно вычислить двумя способами:
1. По известному удельному объёму или удельному весу газа.
Например, при 0° С и 760 мм рт. ст. или Ро=\0 333 кг/м2, уд. вес сухого воздуха равен у0=1,293 кг/м2, следовательно, газовая постоянная для воздуха будет:
![]()
2. По молекулярному весу газа из уравнения
р-848
где М —молекулярный вес газа. Для воздуха
М= 28,966,
тогда
^w"29*27*
так как 848 — газовая постоянная одного моля.
Таким образом, оба способа дают практически одинаковые результаты.
Газовая постоянная для смеси газов может быть определена теми же способами, что и для индивидуальных газов, а именно:
где Gl9 G2, G3 — содержание отдельных газов в смеси по весу,
RlfRz, Rз — газовые постоянные отдельных газов, входящих в смесь,
G — вес смеси.
п 848 848
Мг+?*.
где Mlf М2, М3 — молекулярные веса отдельных газов, входящих в смесь;
Мср — средний молекулярный вес смеси;
, -у-, у-. — относительные объёмные содержания отдельных газов в смеси.
Законы Бойля-Мариотта и Гей-Люссака имеют значительные отклонения.
Чтобы отразить наиболее точно законы сжатия и расширения газов с учетом объёма молекул и сил притяжения и?с, голландский физик Ван-дер-Ваальс в 1879 г. предложил уравнение следующего вида:
(P+yi2)(V-b)=RT, (8)
где а — константа сцепления молекул;
b — учетверенный объём газовой молекулы.
для метана а = 0,00357; b =0,00161;
для этана а = 0,0160; 6=0,0028;
для пропана а — 0,01727; & =0,00377;
Уравнение Ван-дер-Ваальс а дает более точные данные для изменения объёма газа, чем закон Бойля-Мариотта, однако широкому его распространению препятствует отсутствие необходимых экспериментальных данных по установлению констант в этом уравнении.
ЗАКОН ДАЛЬТОНА
В 1800 г. английский химик и физик Джон Дальтон установил закон парциальных давлений, названный впоследствии законом Дальтона. Этот закон гласит: общее давление газовой смеси складывается из суммы парциальных давлений, которые создаются каждым отдельным газом, как будто каждый газ занимает все пространство.
Р = Pi + Pz +р3 + •.. +рп (9)
Где Р — общее давление газовой смеси;
Pi, Pz> Рз> • • • Рп — парциальные давления отдельных газов.
Амага аналогично установил закон парциальных объёмов: общий объём, занимаемый смесью газа, равен сумме парциальных объёмов отдельных газов или
V — v1-j-vz-\-v3Jr...vn (Ю)
где V — объём газовой смеси;
vu у2> "з — парциальные объёмы отдельных газов, приведенные
к общему давлению.
ЗАКОН АВОГАДРО
В 1811 г. итальянский физик Авогадро, рассматривая отношения объёмов элементарных газов и их газообразных химических соединений, сделал предположение, что равные объёмы любых газов .при одинаковых температуре и давлении содержат одинаковое число молекул. Впоследствии это предположение было подтверждено и получило силу закона, названного именем Авогадро.
Из этого закона следует также, что удельные веса газов у при одинаковых температурах и давлениях прямо пропорциональны молекулярным весам М, т. е.
У\ _ М1 .
Уг М2 ’
так как
У1 _
у2 Vi ’
то
M1v1 = M2v2 = MV = const. (И)
Весовое количество М кг газа (где М — молекулярный вес) носит название килограмм-молекулы. Таким образом, уравнение Mu=const свидетельствует, что объём одной килограмм-молекулы для данных температуры и давления для всех газов есть величина постоянная. Эту величину можно определить, зная удельный объём или удельный вес газа и его молекулярный вес Так, например, удельный вес кислорода при 0° и 760 мм рт. ст. равен у—1,429 кг)мг, молекулярный вес М= 32, тогда 1 моль кислорода весит 32 кг и занимает объём 32 : 1,429=22,4 м3.
Удельный вес газа может быть определен по его молекулярному весу из следующего соотношения:
y=^j = 0,0445-М кг/м*, где М — молекулярный вес газа.
ЗАКОН ГЕНРИ
Изучая растворимость газов в жидкостях, английский химик Генри в 1803 г. установил, что если газ и жидкость не действуют друг на друга химически, то при постоянной температуре весовое количество газа, растворяющегося в определенном количестве жидкости, приблизительно прямо пропорционально абсолютному давлению этого газа на жидкость. Если над жидкостью находится смесь газов, то каждый газ растворяется пропорционально своему парциальному давлению.
Изучение растворимости газов в нефтях имеет большое практическое значение.
Растворенный газ несколько увеличивает объём нефти, понижает ее удельный вес и вязкость, способствуя более быстрому притоку ее к забою скважины. Растворимость газа в жидкости протекает до определенного предела, т. е. до насыщения жидкости. Этот предел зависит от характера и объёма жидкости, от состава и давления газа и от температуры.
Отношение объёма растворенного газа (при давлении растворения) к объёму жидкости для заданной температуры является постоянной величиной и называется коэфициентом растворимости данного газа в данной жидкости. Этот коэфициент колеблется в значительных пределах от 0,25 до 2,0. Для бакинских нефти и газа при /=40° С и Р=65 ата коэфициент растворимости равен 0,576.
ЗАКОН РАУЛЯ
Растворение какого-либо газа в жидкости будет происходить да тех пор, пока парциальное давление в газе сравняется с его парциальным давлением в жидкости. Тогда наступает равновесие фаз* Закон Рауля определяет это физическое равновесие математически: р=д х и читается так: парциальное давление растворенного газа или пара (р) в жидкости равно произведению упругости этого газа в чистом виде при данной температуре (0) на мольную концентрацию его в жидкости (х).
По закону Дальтона, парциальное давление компонента в паровой фазе (Pi) равно произведению мольной концентрации этого компонента в паровой фазе (у) на общее давление (Р), т. е. р1:=Ру-
Так как при равновесии фаз парциальные давления в паровой фазе и в жидкости равны, то можно написать:
![]()
где К — константа равновесия.
Константы равновесия для каждого компонента зависят от температуры и давления. Обычно их значения для расчетов берут • из кривых.