Глава 7 алканы нефти
Глава 7 АЛКАНЫ НЕФТИ
7.1. СОДЕРЖАНИЕ АЛКАНОВ В НЕФТЯХ И ПОПУТНЫХ ГАЗАХ
Алканы представляют собой газообразные, жидкие или твердые вещества. Газообразные соединения содержат в цепи от 1 до 4 атомов углерода (Ci—С4) и входят в состав попутных и природных газов (метан, этан, пропан, бутан, изобутан). Соединения, содержащие от 5 до 15 атомов углерода (С5—С15), представляют собой жидкие вещества. Начиная с гексадекана (Ci6) «-алканы являются твердыми веществами, которые при обычной температуре могут находиться в растворенном или кристаллическом состоянии в нефти и высококипящих фракциях.
Общее содержание алканов в нефтях в основном составляет 25—30 % (не считая растворенных газов). С учетом углеводородов, находящихся в растворенном состоянии, содержание алканов повышается до 40—50, а в некоторых нефтях — до 50—70 %. Однако есть нефти, в которых содержание алканов составляет всего 10—15%. Из отечественных нефтей наиболее богаты алканами озексуатская (Ставропольский край), мангы-шлакские, грозненская парафинистая, некоторые эмбенские и ферганские, ишимбаевская, майкопская, туймазинская, бугу-русланская, ромашкинская, марковская и ряд других (табл. 7.1).
Таблица 7.1. Содержание алканов в типичных нефтяных основных нефтеносных районов СНГ
| Район, нефть | Выход фракций, перегоняю |
Содержание | Содержание алканов в расчете на сумму фракций 28—200 °С, % | |
| щихся до 350 °С, % | парафина, % | нормаль ных |
развет- вленных | |
|
Западная Сибнрь усть-балыкская, западно | 39-68 |
0,5—0,8 | 24—42 |
28-51 |
| сургутская, самотлорская Восточная Снбнрь марковская | 55—92 |
33—35 | 38—54 | |
| Азербайджан сураханская масляная, ба-лаханская, бибнайбатская, | 38—59 | 0,52-0,96 | До 27 | До 23 |
|
. |
(преобладают цикло- | |||
|
карадагская, масляная, би-нагадинская карадагская парафннн- | 9,6-13,8 | ял каны) | ||
| стая, зыринская остальные |
1,6-4,6 |
_ | ||
| Чечня |
- | 1,6-4,6 Высокопа- | 45- |
-66 |
| Северный и Южный Даге | - |
29—31 | 31-33 | |
| стан Ставропольский край | 48,5-58,5 |
рафниистые 14,3—23,6 |
51-78 | _ |
|
Украина предкарпатскне | __ | 8,0-17,5 | Преобладают цикло | |
| остальные |
|Малопара- |
алканы | ||
|
Белоруссия | 40,2-59,3 | финистые 6 | Преобладают н-алка- | |
| Куйбышевская обл. |
(фракции перегоняются до 300°С) |
Парафини- |
ны Высокое содержание |
|
| Оренбургская обл. |
27-65 | стые | алкаиов 58—75 39—43 | |
| Саратовская обл. | До 74,5 | 6,6-10,4 |
34- | -55 |
|
Волгоградская обл. |
— | — |
38- | -66 |
|
Выход фракций, |
Содержание | Содержание алканов в расчете иа сумму фракций 28-200 °С, % | ||
| Район, нефть |
перегоняющихся до 350 °С, % |
парафина, % | нормаль ных | развет вленных |
Астраханская обл. Татарстан
Узбекистан и Кыргызстан
40—47
42—55
11—26
Высокопа-
рафннистые
До 83 55-69 50—60
Казахстан
8—35,3 0,44—2,74 50—90
анжарскне и каратюбин-ские
61,5—62
30—50
кеикнякекие
Мангышлак
Сахалин
катенглийская
Некрасов- 72,8—82
паромайская, с кая
тунгорская
Башкортостан
Парафини-
стые
9—29
30,9—55,6 Не более 1
4,87
Преобладают разветвленные алканы ,
То же
28—56
20—58 Преобладают циклоалканы
То же
(от 40 до 80) 59-77
С повышением средней молекулярной массы фракций нефти содержание в них алканов уменьшается. В средних фракциях, перегоняющихся в пределах 200—300°С, их содержится обычно уже не более 55—61 %, а к 500°С, как правило, количество этих углеводородов снижается до 19—5% и менее. Исключение составляют высокопарафинистые нефти полуострова Мангышлак. Так, в узенской нефти с увеличением температуры отбора фракций четко проявляется тенденция к увеличению содержания алканов, хотя в более тяжелых фракциях оно постепенно снижается.
Содержание алканов в нефтях зависит от месторождения. Например, в широкой фракции н. к. — 300°С их содержание в . мангышлакской нефти достигает 88%, нефтях Сибири 52— 71 %, татарских — 55 % и бакинских 30—40 %. В высших фракциях нефти алканы представляют собой твердые вещества.— парафин и частично церезин.
Алканы нефти представлены изомерами нормального и разветвленного строения, причем их относительное содержание зависит от типа нефти. Так, в нефтях глубокого превращения алканы часто составляют 50 % и более от содержания всех изомеров, затем следуют изомеры с метильной группой в положении 2. Несколько ниже содержание изомеров с заместителем
в положении 3. Среди монозамещенных изомеров основное количество составляют изомеры с заместителями в положениях 2 или 3. Двухзамещенные при одном атоме углерода изомеры не имеют большого распространения, преобладают изомеры, имеющие симметричное строение.
В небольших количествах обнаружены также изомеры алканов, в которых боковая цепь длиннее метила. Имеются и исключения из этого правила. Например, в анастасиевской нефти Краснодарского края и нефти месторождения Нефтяные Камни найдены сильноразветвленные углеводороды, в то же время в анастасиевской нефти практически нет гексана, гептана и октана.
Нефти нафтеновой природы содержат алканы в основном изостроения — до 75% и более. В бензине жирновской нефти среди разветвленных углеводородов явно преобладают д-изаме-щенные. В жирновской нефти не оказалось простейших циклоалканов (циклопентана и циклогексана).
В нефти из месторождения Нефтяные Камни в бензиновой части разветвленных алканов с одним третичным углеродным атомом найдено несколько меньше половины всех алканов, затем следуют углеводороды с двумя заместителями и совсем мало — с тремя.
Разветвленные алканы распределяются неравномерно по различным фракциям нефти. Так, в нефти Понка-Сити »50 % их количества приходится на фракцию С6—Сю, 32,2 % — на фракцию Сц—С17 и только 10,8 % — на фракцию Ci8—С25. Углеводородов С26—С38 в этой нефти содержится «5,9% в расчете на сумму разветвленных алканов.
Новейшими методами изучен индивидуальный углеводородный состав фракции 140—180°С нефти Понка-Сити. Было выделено и идентифицировано 49 алканов и циклоалканов— 84 % от всех возможных углеводородов погона, или 10 % в пересчете на нефть, в том числе шесть диметилоктанов из 12 возможных: 2,4-, 2,5-, 2,6-, 3,4-, 4,4- и 4,5-. Остальные шесть диметилоктанов: 2,2-, 2,3-, 2,7-, 3,3-, 3,5- и 3,6—по-видимому, содержатся в нефти лишь в незначительных количествах. Два углеводорода — 2,6-диметилоктан и 2-метил-З-пропилгексан — содержатся в нефти в необычно больших количествах (0,55 и 0,64%). Первый из них может быть отнесен к гидрированным аналогам ациклических изопреноидов; второй мог произойти из моноциклического терпена — сильвестрена. Содержание каждого из остальных углеводородов не превышает сотых долей процента.
Мировые разведанные запасы газа по состоянию на начало 1980 г. оценивались величиной порядка 80 трлн м3, к этому времени суммарная добыча газа составила 29,6 трлн м3. Всего открыто около 11 тыс. месторождений природного газа, из них
с запасами более 30 млрд м3 составляют 2,4 % всех месторождений. Начальные запасы учтенных 236 месторождений оцениваются в 75 трлн м3. Таким образом, 236 крупных (30— 100 млрд м3), крупнейших (100—1000 млрд м3), уникальных (более 1000 млрд м3) месторождений содержат около 65 % запасов мира. При этом запасы 15 уникальных месторождений содержат 40,6 трлн м3 запасов газа мира, или 35,1 %. Таким же образом распределены по месторождениям и нефтяные ресурсы. ,По данным М. Т. Хэлбути и соавторов, 187 крупнейших нефтяных месторождений с запасами более 70 млн т каждое содержат 85 % мировых запасов нефти и обеспечивают большую часть добычи.
В США учтено 40 крупных месторождений с начальными запасами 6 трлн м3, из них 2,04 трлн м3 приходится на уникальное месторождение Хьюготон-Панхэндл.
Крупные и крупнейшие газовые месторождения открыты в Канаде, Великобритании, Алжире, Нидерландах, Норвегии,. Франции, Пакистане, Иране и других странах, уникальные — в Нидерландах (Гранинчел), Алжире (Хасси-Рмель), Иране (Пазенуп, Паре, Канган). Открыт ряд крупных нефтяных месторождений в Мексике (Бермудес, Никонтенек и др.), содержащих крупные запасы растворенного газа и газовых шапок. Значительные запасы растворенного газа сосредоточены также в странах Персидского залива, Южной Америке и др.
Сырьевая база газовой промышленности СССР начала .со* здаваться в годы Великой Отечественной войны. В эти годы открыты месторождения Саратовского Поволжья. В 50-х годах основной прирост добычи газа был получен за счет месторождений Украины, Северного Кавказа и западной части Узбекистана. Был открыт ряд крупных месторождений, таких как Шебелинское на Украине, Северо-Ставропольское, Газлинское-в Узбекистане и др. К этому времени относится открытие первых газовых месторождений в Западной Сибири и Якутии.
Богатейшим месторождением природного газа является Уренгойское в Восточной Сибири. Этот газ характеризуется следующим объемным составом, %:
СаН„ 0,82 - 5,81 С3Нв 0 - 5,3 ? С4 0,014-2,05 ?С 5 0,02 — 0,18
Na 0,90 - 1,09 СОа 0,21-0,44 СН4 85,31 -97,88
Газ практически не содержит сероводорода. Проложен магистральный газопровод Восточная Сибирь — Западная Европа,
В зависимости от месторождений углеводородные газы подразделяют на природные, попутные и газы газоконденсатных месторождений.
Природные газы добывают с чисто газовых месторождений. Они состоят в основном из метана с небольшой примесью этана, пропана, бутанов, пентанов, а также азота, сероводорода и диоксида азота (табл. 7.2). Эти газы относятся к группе сухих. Содержание метана в них в основном 93—98 %, этана и пропана — незначительно. Более высокомолекулярные углеводороды, как правило, присутствуют в виде следов, хотя некоторые газы характеризуются их-повышенным содержанием. В газах имеется небольшая примесь диоксидов углерода и азота.
Попутные газы добывают совместно с нефтью. При выходе нефти на поверхность газ вследствие снижения давления выделяется из нефти. Попутные газы (табл. 7.3) относятся к жирным и служат источником для извлечения из них легкого бензина — так называемого газового бензина.
При переработке нефти из нефтезаводских газов на газофракционирующих установках (ГФУ) получают следующие углеводородные фракции (чистотой 90—96°/о):
этановая — сырье для пиролиза, хладоагента на установках депарафинизации масел и выделения ксилола и др.;
пропановая — сырье для пиролиза, получения ожиженного газа, хладоагента;
изобутановая — сырье для алкилирования и производства синтетического каучука;
Т а б л и ц а 7.2. Объемный состав природных газов некоторых месторождений, %
|
Месторождение | СН4 | С2Н„ |
С3Н8 | С.Н.о |
С5Н12 | со, | N2 4- редкие газы |
| Саратов | 94,7 |
1,80 | 0,25 | 0,05 |
3,0 | 3,0 | |
| Майкоп * | 53,6 |
14,2 | 11,7 | 8,2 |
5,4 | 6,9 | |
| Краснокамск | 19,4 |
— | 48,6 | _ |
_ | 0,4 | _ . |
| Фергана | 63,0 |
— | 27,3 | — | _ | 3,0 | _ |
| Ставрополь |
98,0 | 0,61 | 0,44 |
0,05 | — | 0,9 | _ |
|
-Мельникове | 88,0 | 0,8 | _ | _ | |||
| Дашава |
98,3 | 0,33 | 0,12 |
0,15 | _ | — | 0.J5 |
| Г азли | 94,9 | 3,5 |
0,9 | 0,6 | _ |
_ | _ |
|
Уренгой | 98,5 | 0,10 | Следы | Следы |
Нет | 0,21 | 1,112 |
| Медвежье |
98,6 | 0,35 | 0,02 |
0,003 | 0,04 | 0,22 | 0,017 |
|
Комсомольское | 97,8 |
0,15 | 0,004 | 0,001 |
Нет | 0,28 | 1,74 |
| Заполярное |
98,5 | 0,20 | 0,05 |
0,012 | Следы |
0,50 | 0,70 |
| * Содержит 220 | г/м3 газового бензина. | ||||||
|
Месторождение | сн4 | С2н6 |
СзН5 | с,н10 |
С5н12 |
со2 | н2 | N24-+ редкие газы |
| Туймазинское | 41 |
19,5 | 18,3 | 6,4 | 2,8 | _ | _ | 12,0 |
| Западный Куш-Даг | 86,8 | 4,5 | 3,0 | 2,0 |
3,2 | 0,4 | - |
0,1 |
| Анастасневско-Т ронцкое | 85,1 | 5,0 | 1,0 | 1,0 |
2,8 | 5,0 | - |
0,1 |
| Ново-Дмитровское | 69,2 | 10,0 |
10,0 | 5,0 | 5,0 |
0,7 | - | 0,1 |
| Соколово-Г орское |
53,0 | 9,0 | 11,2 |
10,0 | 5,8 | 1,0 | - | 10,0 |
|
Шпаковское | 41,2 |
15,0 | 15,8 | 6,9 |
4,0 | 0,1 | - |
17,0 |
| Бавлинекое | 38,5 | 21,0 |
20,0 | 8,0 | 3,5 |
0 | - | 9 |
| Яблоновый овраг |
29,6 | 16,0 | 16,5 |
8,8 | 3,5 | 0,6 | - | 27 |
|
Ишим байское | 53,6 |
14,9 | 12,7 | 7,7 |
2,6 | 0,8 | 4,0 | 3,7 |
| Ромашки некое | 46,5 | 21,4 |
14,4 | 4,5 | 2,2 | — | — |
11,0 |
| Мухановское |
31,4 | 19,0 | 22,0 | 9,5 | 5,0 |
4,0 | 0,1 | 9,0 |
| Грозненское | 30,8 | 7,5 | 21,5 |
20,4 | 19,8 | — |
— | — |
|
Апшеронскнй полуостров |
90—94 | 0,1—3,0 |
0,1—0,8 | 1,6 | 0,3-2,0 | 1—8 |
н-бутановая — сырье для пиролиза, производства синтетического каучука, компонента бытового ожиженного газа и др.;
изопентановая — сырье для производства изопренового каучука и компонента высокооктановых бензинов;
пентановая — сырье для процессов изомеризации и пиролиза, получения амиловых спиртов.
В последние годы в нашей стране в связи с увеличением глубины разведочных скважин и освоением новых перспективных территорий открывается все больше газоконденсатных и нефтегазоконденсатных залежей, конденсат становится самостоятельным полезным ископаемым.
Газоконденсатные залежи — это скопления в недрах газообразных углеводородов, из которых при снижении давления выделяется жидкая углеводородная фаза — конденсат (смесь углеводородов — пентана и более высоких гомологов метана).
Конденсат бывает сырой и стабильный. Сырой конденсат представляет собой жидкость, получаемую непосредственно в промысловых сепараторах при данных давлении и температуре. Он содержит жидкие при нормальных условиях углеводороды, в которых растворено то или иное количество газообразных углеводородов. Стабильный конденсат получают из сырого путем его дегазации.
Содержание конденсата в газе различных газоконденсатных залежей изменяется в широких пределах. Известны газоконденсатные залежи с содержанием стабильного конденсата от б—10 см3/м3 (Рудки, Пунгинское) до 300—500 см3/м3 (Русский Хутор, Вуктыл) и даже 1000 см3/м3 и более (Талалаевское).
К 1970 г. были открыты Вуктыльское и Оренбургское газоконденсатные месторождения, Уренгойское, Медвежье, Ямбург-ское, Заполярное, Губкинское, в Западной Сибири, Ачакское, Наипское, Шатлыкское в восточной части Туркменистана.
Была подтверждена высокая газоносность полуострова Ямал, Северной части Тимано-Печорской провинции, западной части Узбекистана и других территорий. В этот период были открыты такие крупные месторождения, как Западно-Крестищенское на Украине, Лаявожское и Ванейвисское в Архангельской области, Харасавэйское, Бованенковское и Южно-Русское в Тюменской области, Шуртанское в Узбекистане, Соболох-Неджелинское в республике Саха и др.
К началу 1981 г. в СССР открыто более 900 газовых, газоконденсатных и газонефтяных месторождений, в том числе 93 с запасами газа свыше 30 млрд м3. Среди них месторождения Уренгойское, Ямбургское, Заполярное, Медвежье, Бованенковское и Оренбургское в сумме содержат 57% разведанных запасов страны, а вся группа крупных месторождений — более 94 %.
На газовые, газоконденсатные месторождения и месторождения, состоящие из чередующихся нефтяных и газовых залежей, приходится более 95 % разведанных запасов газа СНГ.
На севере Тюменской области разведано крупное месторождение газа. Зоны газонакопления выявлены также на востоке распублики Коми, в Оренбургской области, в республике Саха, на Северном Кавказе, в Прикаспии, в Днепровско-Донецкой впадине, на востоке и севере Туркменистана, в Западном Узбекистане.
Размещение 87 % разведанных запасов газа в районах Сибири и Средней Азии, вдали от потребителей, вызывает необходимость строительства мощных газовых магистралей протяженностью 2,5—4,0 тыс. км.
К настоящему времени на территории России открыто свыше 700 газовых, газоконденсатных и газонефтяных месторождений. Из них в разработку вовлечено уже более 300 месторождений с разведанными запасами порядка 26 трлн м3 (53 % всех российских газовых запасов). К промышленному освоению подготовлено еще 56 месторождений с запасами почти в 14 трлн м3, в стадии разведки находятся около 200 месторождений с запасами немногим более 8 трлн м3. В консервации насчитывается 130 относительно небольших месторождений со средними запасами около 1,5 млрд м3.
Разведанные запасы газов с содержанием этана до 3 °/о в России составляют немногим более 18 трлн м3 (39 % всех запасов). В 125 разведанных этансодержащих газовых месторождениях сосредоточено около 1,1 млрд т этана, свыше 550 млн т пропана и более 350 млн т бутанов. Свыше 70 °/о этих запасов этана, пропана и бутанов приходится на месторождения Западной Сибири.
Месторождения сероводородсодержащих газов в России, общие разведанные запасы которых составляют более 4 трлн м3, находятся в основном в Архангельской, Оренбургской, Астраханской и Пермской областях, а также в Башкортостане.
Разведанные извлекаемые запасы газового конденсата, оцененные по 275 месторождениям, составляют около 1,7 млрд т,.. из них 60 % приходится на долю западносибирских месторождений.
В предстоящие 20 лет разведанные запасы газа в России при намечаемых объемах его добычи сократятся на 15— 20 трлн м3. Для сохранения высокого ресурсного обеспечения российской газовой промышленности в период до 2010 г., т. е. за те же 20 лет, намечается разведать 20 трлн м3 газа.
Фактическая (на 1990 г.) и прогнозируемая добыча газа в России (в млрд м3):
|
1990 | 2000 | 2010 |
2020 | |
| Восточная Сибирь | 540 |
780 | 920 |
930 |
| район Надым — Пур- | 540 |
680 | 650 |
520 |
| тасово | ||||
|
район Ямала | — |
100 | 270 |
270 |
| район Гидана | — | — | — | 140 |
| Каспийский регион |
42 | 40 |
30 | 20 |
|
Оренбургская область |
40 | 30 | 20 | 10 |
|
Астраханская область | 2 | 10 | 10 | 10 |
| Остальные районы | 14 | 10 |
20 | 30 |
|
Всего по России | 596 | 830 | 970 |
980 |
|
ланируется освоение |
Штокмановского |
газового | месторож- | |
дения в акватории Баренцева моря. На первом этапе здесь намечается получить до 10 млрд м3 газа, а в перспективе до 20 млрд м3 в год. Месторождение расположено в сложных ледовых условиях и под толщей воды глубиной 250—300 м.
Важным источником углеводородного сырья является попутный нефтяной газ. До недавнего времени попутный газ в СССР в основном сжигался в факелах на промыслах и лишь частично использовался на местные нужды. Так, в 1991 г. при общеотраслевых ресурсах нефтяного газа в 45,1 млрд м3 было добыто 35 млрд м3 и более 10 млрд м3 сожжено в факелах и только 7,4 млрд м3 газа поставлено на переработку и компримиро-вание.
Газы газоконденсатных месторождений содержат большое количество метана, а также высокомолекулярных углеводородов, входящих в состав бензиновых, керосиновых, а иногда и дизельных фракций нефти. Большая часть разведанных и введенных в эксплуатацию за последние годы газовых месторожде-
Таблица 7.4. Объемный состав газов некоторых газоконденсатных месторождений, %
|
Месторождение | СН, |
С2Нв | СзН, |
С,Н10 | С02 |
С5 н более высоко-кипящие (тяжелые) | n2 + + редкие газы |
|
Шебелинское | 93,6 |
4,0 | 0,6 | 0,7 |
0,1 | 0,4 | 0,6 |
| Степновское (Са |
95,1 | 2,3 | 0,7 | 0,4 | 0,5 |
0,8 | 0,5 |
|
ратовская область) | |||||||
|
Карагандинское | 89,3 |
3,1 | 1,8 | 1,1 | - | 4,7 | — |
| Киевское |
88,5 | 3,8 | 2,9 |
1,7 | - | 1,3 |
1,4 |
| -Мессояхское * | 98,87 |
Следы | — | — | 0,68 | — |
0,455 |
| Губкинское * | 97,50 | 0,12 |
0,015 | сл. | 0,10 | Следы | 1,244 |
| Заполярное * |
98,50 | 0,2 | 0,05 |
0,012 | 0,50' |
Следы | 0,70 |
| Комсомольское * | 97,80 | •0,15 | 0,004 |
0,001 | 0,28 | Нет | 1,71 |
| Медвежье * | 98,63 | 0,35 |
0,02 ¦ | 0,008 | 0,22 | 0,04 | 0,74 |
| * Север Тюменской области. | |||||||
ний относится к газоконденсантному типу. В газах этих месторождений содержатся 2—5 % и более жидких углеводородов (табл. 7.4).
Конденсаты, как и нефти, состоят из алканов, нафтенов и аренов. Однако распределение этих групп углеводородов в конденсатах имеет ряд особенностей:
абсолютное содержание (в среднем) аренов в бензиновых фракциях конденсатов выше, чем в нефтях;
встречаются бензиновые фракции, в которых содержится одновременно большое количество нафтенов и аренов;
между содержанием алканов и ареиов в бензиновых фракциях существует обратная связь (чем больше алканов, тем меньше ареиов);
содержание разветвленных алканов ниже, чем н-алканов. Конденсаты с высоким содержанием аренов широко распространены на территории Аму-дарьинской и Днепровско-Донецкой впадины (соответственно до 60 и 28—31 %)•
Газоконденсаты Западного Предкавказья в направлении регионального погружения от Староминско-Ленинградского до Усть-Лабинского характеризуются изменением типа конденсата— от алканового через алкаио-иафтеиовый и алкаио-арено-вый до арено-алканового. Отношение алкаиов к аренам в этих конденсатах составляет соответственно 17—22; 5,4—7,2; 0,8—1,2 и 0,7—0,8, а содержание ароматических углеводородов возрастает от 3—4 до 44—48 %.
Основную часть конденсатов всех исследованных газоконденсатных месторождений Средней Азии (было изучено 50 различных конденсатов) составляют бензиновые (лигроииовые) фракции (100—200 °С) или углеводороды состава С7 — С13; содержание в конденсатах легкой части (до 100°С) редко превышает 10%- Некоторые конденсаты отличаются высоким содержанием гомологов бензола (20—30 % и выше) и гомологов циклогексана (до 20—25 %); другие — низким содержанием этих углеводородов и повышенным — гомологов циклопентана.
Углеводородный состав конденсатов характеризуется следующими закономерностями. Среди алканов разветвленного строения преобладают монометилзамещенные: 2-, 3- и 4-метил-замещенцые. В наибольшем количестве содержатся 2-метилпеи-тан, 2-метилгеКсаи и 2-метиЛгептан. Среди диметилпроизводных присутствуют главным образом 2,3- и 2,4-диметилизомеры. Цик-лопентановые углеводороды помимо циклопентана представлены в основном его метил- и этилзамещенными, а также 1,2- и
1,3-диметилциклопентанами. В конденсатах обычно содержатся все три изомера диметилциклогексана, причем на долю 1,3-ди-метилциклогексана приходится от 50 до 70 % количества изомеров.
Представляет значительный интерес состав газа Оренбургского газового и газоконденсатного месторождений. Залежь газа массивная, высота залежи 514 м, она имеет нефтяную оторочку. Раздел газ — нефть находится на отметке 1750 м, а раздел вода — нефть — на отметке 1770 м. Из всех скважин кроме газа выносятся конденсат и сероводород. Объемный состав газа Оренбургского месторождения, %:
| СН4 |
81,5 | С5Н12 |
0,4—2,8 |
| СйНв | 3,1— 5,4 |
СвНн и высшие |
0—0,9 |
| СзН, | 1,03—2,1 | N* | 2,4—7,4 |
|
ИЗО-С4Н10 | 0,15—0,7 | С02 |
1,0—3,2 |
|
W-C4H10 | 0,32—21 |
H2S | 1,3—4,5 |
В разных частях этой большой залежи содержание отдельных компонентов несколько различается.
Астраханское газоконденсатное месторождение приурочено к Ширяевскому локальному поднятию, выявленному в 1968— 1970 гг. сейсморазведкой. Залежь газоконденсатная, массивная, с размерами 30X25 км. Пластовое давление 61 МПа.
В скважине 8 данного месторождения в интервале 3956—3915 м дебит газа составил 1 млн м3/сут при диаметре штуцера 25 мм, а в интервале 4067—4035 м — 25 тыс. м3/сут при диаметре штуцера 14,3 мм.
Состав газа скважины 8, °/<ь
Метан 47,5—54,15 Пропан 0,93—1,68
Этан 1,92—5,54 Бутан 0,44—0,93
Пеитан и вые- 0,35—1,57 Диоксид углерода 17,9—21,55
шнс алканы Азот 1,98
Сероводород 20,7—22,5
Содержание конденсата в газе более 400 г/м3.
На базе месторождения создан газохимический комплекс •с получением из газа этана, ожиженных газов, серы и других ценных компонентов.
Зарубежные газовые месторождения. В Европе наиболее значительные газовые месторождения известны в Нидерландах, Франции, на прилегающих к Англии морских площадках Северного моря, в Италии и Румынии. В газовых месторождениях зарубежных стран главным компонентом является метан, а содержание тяжелых углеводородов невелико. В таких крупнейших газовых месторождениях США, как Хьюготон и Пан-хендль, содержание тяжелых газообразных углеводородов несколько повышенное (до 12—14%).
Во многих газовых и газонефтяных месторождениях США содержание метана обычно 70—90 %, бывает и выше. В составе растворенных в нефти газов содержание углеводородов С2 — С5 более высокое и достигает в ряде случаев 40—50 %.
В ряде месторождений США, приуроченных к отложениям триаса, перми и карбона, высоким является содержание азота (до 80—90 %). В этих же газовых месторождениях (штаты Монтана, Нью-Мексико, Юта, Колорадо и др.) наблюдается повышенное содержание гелия.
В газах некоторых газовых месторождений значительно содержание сероводорода. Так, в газе крупного газоконденсатного месторождения Лак (Франция) содержание сероводорода около 15% (табл. 7.5). Новые месторождения газа были открыты в Западной Европе в шельфах Северного моря и в прибрежных зонах Великобритании и Норвегии. В районе Аляски было открыто месторождение газов, резервы которого оценены в 15-Ю12 м3. Существенно расширены геологоразведочные работы в шельфах морей и океанов Африки, Азии и Латинской Америки. Эксплуатация месторождений, расположенных в труднодоступных зонах, привела к увеличению капиталовложений и эксплуатационных затрат, а также расходов на решение экологических проблем.
Кроме классических месторождений природных газов
Таблица 7.5. Состав газов некоторых зарубежных газовых и газонефтяных месторождений
| Месторождение |
сн( | С 2-Сд | со. | Ns | На | HjS | Hu |
| Кэн, Калифорния (США) | 99,3 | 0,4 |
0,1 | 0,1 |
— | 0,15 | |
| Свитвоте, Вайоминг (США) |
75,6 | 1,3 |
2,7 | 20,2 |
— | - |
0,75 |
| Слохтерен (Нидерланды) | 81,3 |
3,5 | 0,8 |
14,4 | — |
15 | — |
|
Лак (Франция) | 74 |
2 . | 9 |
~ | - |
имеется и другой существенный их энергоисточник — кристаллогидраты. Начиная с 1960 г., интенсивно изучаются свойства кристаллогидратов, что связано с обнаружением крупных месторождений этого вида сырья в России и других странах. Полагают, что кристаллогидраты могут образовываться в районах с пониженной температурой (Сибирь, Аляска, Канада, полярные зоны земного шара).
Считают, что запасы газа в капиталистических странах позволят удвоить erb добычу по сравнению с добычей 80-х годов на период примерно в 90 лет. Основная часть запасов газа сосредоточена не в основных потребляющих странах. По данным МЭА, экспортный потенциал развивающихся стран к 2000 г. возрастет в 4,2—9,2 раза и достигнет 164—358 млрд м3 в год.
Технологические процессы эксплуатации газовых месторождений существенно проще нефтяных, а стоимость транспортирования и хранения природных газов значительно выше стоимости транспортирования и хранения жидких углеводородов. Наиболее экономичным является транспорт сжиженного газа. При использовании трубопроводов диаметром 420 мм (давление 7,5 МПа) компрессорные станции потребляют до 15 % газа при подаче его на расстояние 6000 км (Тюмень — Западная Европа). Снижение расходов на транспортирование газа намечается за счет перевода станций на электроприводы и увеличения пропускной способности трубопроводов при охлаждении газов до —60 °С.
По данным комиссии МИРЭК, потребление газа в 2020 г. составит 3,6 трлн м3 по сравнению с 1,7 трлн м3 в 1979 г. Основные экспортеры газа — Россия, Нидерланды, Канада, Норвегия, Алжир и Индонезия. Основные страны—импортеры газа — США, Япония, Италия, ФРГ, Франция, Великобритания и Бельгия.
7.3. ЖИДКИЕ АЛКАНЫ
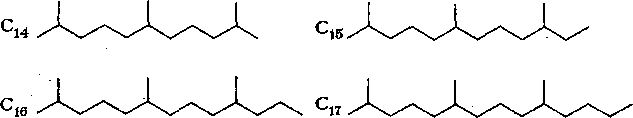
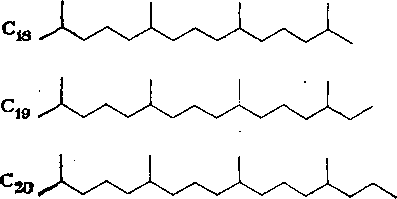
Углеводороды легких фракций нефти. Алканы от С5 до Сд,
входящие в состав бензиновых фракций, в обычных условиях представляют собой жидкости. На основании анализа индивидуальных углеводородов, выделенных из 10 отечественных нефтей, установлено, что бензиновые фракции нефти в основном представлены соединениями с простейшими заместителями. Исключение составляют нефти месторождений Анастасиевского и Нефтяные Камни, в которых имеются изомеры с длинными боковыми цепями.
Анализ данных о содержании индивидуальных алканов н бензиновых фракциях одинаковых пределов перегонки (среднее из 77 отечественных и зарубежных нефтей) показал, что в наибольшем количестве находится простейший углеводород, а следующим за ним изомером обычно является метилзамещен-ный в положении 2 или 3.
Из 35 теоретически возможных нонанов уже выделено 24. Найдены все 5 изомеров гексана, из 9 гептанов — 7, из 18 изомеров октана—16. Количественное содержание сильно разветвленных изомеров незначительно.
Таким образом, на долю «-октана и трех простейших его изомеров приходится более 85 % от суммы октанов. Аналогично на н-гексан и простейшие изомеры приходится 97 % от суммы гексанов.
При исследовании бензинов различных нефтей комбинированным методом было определено до 90 % углеводородов — алканов, циклоалканов С5 и С6 и аренов. Установлены некоторые закономерности в распределении углеводородов в бензине в зависимости от типа нефти. Бензины различных нефтей содержат примерно один и тот же набор углеводородов, однако в неодинаковом количестве, причем 10 углеводородов, присутствующих в бензине, содержатся в наибольшем количестве (табл. 7.6).
В настоящее время надежно установлены основные закономерности в распределении алканов и изоалканов в бензинах нескольких десятков отечественных нефтей всех типов (по
Таблица 7.6. Содержание углеводородов в бензинах некоторых нефтей, %
По данным Ал. А. Петрова
| Углеводород |
Сурахаиская отборная нефть | Туймазинская нефть |
Косчагылская нефть |
| Метилциклогекеан |
20,05 | 3,74 |
13,06 |
|
Циклогексан | 7,37 |
— | 4,64 |
| 1,3-Диметилциклогексан |
5,68 | — |
6,19 |
|
1,2-Диметилциклопентан |
5,49 | — |
2,39 |
|
Метилциклопентан |
4,59 | — |
3,51 |
| 1,2,4-Т риметилциклопента н |
3,45 | — |
4,10 |
|
1,1,3-Триметилциклопентан | 3,16 | — |
3,39 |
|
2-Метилгеисан | — |
— | |
| 1,1 -Диметилциклогексан |
2,99 | — |
— |
|
1,2-Диметилциклогексан |
— | — | 2,27 |
| Этил циклогексан | 2,23 | — | 2,52 |
|
1,2,3-Триметилциклопентаи |
2,05 | — | |
|
З-Метилгексаи | — | 3,43 | — |
| 2-Метипеитан |
— | 3,06 |
— |
| Г ептан | — | 9,74 |
— |
| Гекеан | — | 8,43 |
— |
| Октан |
— | 7,12 | — |
| Пентан | — | 6,32 | — |
| Бутан | — |
4,69 | 3,55 |
| 2-Метилбутан | — | 3,57 | |
|
Всего | 57,06 |
54,79 | 45,62 |
классификации Ал. А. Петрова, раздел 2.2). Выделяют три основных типа бензинов. Оказалось, что составы бензинов всех парафинистых нефтей (тип А1) достаточно близки. При этом соотношение между нормальными и разветвленными изомерами варьирует незначительно. В бензинах нефтей типа А2 значительно ниже содержание «-алканов, а распределение изоалка-нов примерно такое же, что и в бензинах нефтей типа А1. В бензинах нефтей типа Б часто наблюдается аномальное распределение изомеров. Так, среди углеводородов С5 — С& нефтей этого типа наблюдаются высокие концентрации гем- и еыц-замещен-ных структур. В нефтях типа А1 (сургутской, ромашкинской, грозненской парафинистой) содержание м-гексана составляет 52—71 %, м-гептана 55,9—61 %, к-октана 41—54,8%, w-нонана 30,7—38,4 %, н-декана — 39,4—39,9 % (на сумму изомеров соответственно). В нефти типа А2 (Старо-Грозненской) содержание м-алканов С6 — Сю значительно ниже и равно соответг ственно 12,0; 9,5; 4,3; 5,2 и 2,0% (от суммы изомеров).
Среди разветвленных изомеров С6 — С8 в нефтях А1 и А2 резко преобладают метилзамещенные структуры по отношению к дизамещенным. Для четырех указанных выше нефтей это соотношение варьирует в пределах 3,2—15,0. Концентрации геж-замещенных углеводородов незначительны. Напротив, в нефтях группы Б высоко содержание диметилзамещейных структур, как геминальных, так и вицинальных. Например, в анастасиевско-троицкой нефти (группа Б) соотношение моно-и дизамещенных соответствующих гомологов С6 — С9 варьирует в интервале 0,5—0,96. В нефтях группы Б среди метилзамещен-ных углеводородов более высоко содержание 3-метилалканов, а в нефтях А1 и А2 — 2-метилалканов.
Ал. А. Петров систематизировал количественные данные об относительном распределении гексанов, гептанов, октанов, нона-нов, м-деканов в нефтях типа А1, А2, Б и газовых конденсатах. Среди изомерных гексанов в нефтях количественно определены «-гексан, 2- и 3-метилпентаны, а также 2,3- и 2,2-диметилбу-таны. Состав изомеров гептана следующий: «-гептан, 2- и 3-ме-тилгептаны, 2,3-, 2,4-, 2,2- и 3,3-диметилпентаны, а также
2.2.3-триметилбутан. Среди изомеров октана в нефтях определены н-октан, 2-, 3- и 4-метилгептаиы, 2,3-, 2,4-, 2,5-, 3,4-, 2,2-,
3.3-диметилгексаны, а также 2,3,4-, 2,2,3-, 2,3,3-триметилпен-таны.
В алканах Со обнаружено весьма высокое содержание двух углеводородов — 2,3- и 2,6-диметилгептанов. Предполагается, что эти углеводороды принадлежат к соединениям реликтового типа. Среди изомеров Сю отмечено заметное преобладание изо-преиоидного углеводорода 2,6-диметилоктана и 2-метил-З-этил-гептана (до 75 % всех дизамещенных алканов Сю). По мнению Ал. А. Петрова, высокие концентрации 2-метил-З-этилгептана
и 2,3-диметилалканов С7 и С9 в нефтях обусловлены их образованием из реликтовых предшественников путем отрыва алифатических цепей от стеранов.
Углеводороды средних фракций нефти. Значительно труднее исследовать. углеводородный состав средних фракций нефти, что видно на примере изучения ромашкинской и арланской па-рафинистых нефтей. Обе нефти отличаются высоким содержанием серосодержащих соединений (1,8 и 2,84% серы), смолистых веществ (9,0 и 20,3 %); они могут быть отнесены к пара-финистым нефтям (содержание парафина 4,9 и 4,7%). Исследование нефтей проводили по одной программе. Нефть после ' деасфальтизации при низкой температуре перегоняли с выделением фракции 180—350°С, которая и подвергалась дальнейшему исследованию. Фракция содержала около 19% н-алканов и 20 % аренов.
С помощью адсорбционной хроматографии на силикагеле дробные фракции 180—200, 200—300 и 300—350 °С были разделены на две части: 1) смесь алканов и циклоалканов и 2) смесь аренов и серосодержащих соединений. я-Алканы выделяли из смеси методом комплексообразования с карбамидом и затем обычным путем идентифицировали с помощью ГЖХ. Углеводороды, выделенные тиокарбамидом, помимо н-алканов содержат некоторое количество алканов разветвленного строения и циклоалканов. Так, было установлено, что кристаллизующиеся углеводороды фракции 300—350 °С ромашкянской нефти, образующие комплекс с тиокарбамидом, содержали 60 % н-алканов и «40% изоалканов и циклоалканов. В ходе исследования был разработан другой метод выделения и-алканов из смеси насыщенных углеводородов с помощью адсорбционной хроматографии на угле. В дальнейшем этот метод был усовершенствован и применен для разделения алканов и циклоалканов разветвленного строения — наиболее трудно разделяемой смеси углеводородов нефти. В дистилляте 180—350 °С ромашкинской и арланской нефтей найдены н-алканы от Си (унде-кана) до Сго (эйкозана). Содержание каждого из этих углеводородов составляет 0,4—0,5%. На основании анализа керосиновых фракций 77 отечественных и зарубежных нефтей показано, что в них присутствует десять изомеров декана. Некоторые изомеры частично выделены, а большая часть обнаружена спектрофотометрически. Из углеводородов Си — Cie в этих фракциях найдены уцдскан, додскан, три- и тетрадекан, пентадекан и гексадекап (цетаи).
Ал. А. Петров исследовал сочетанием методов ГЖХ и масс-спектрометрии алканы средних и высококилящих фракций отечественных нефтей различных типов. В них надежно количественно определены моно- и диметилзамещенные алканы Си — С15. Метилзамещенные алканы симметричного строения
(5-метилнонан, 6-метилундекан) содержатся в значительно меньших количествах, чем остальные изомеры. Эта тенденция наблюдалась также для 4-метилгептана и 3-метилпентана.
Содержание метилзамещенного изомера снижается по мере перемещения СН3-группы к центру молекулы. Отношение суммарного содержания монометилзамещенных алканов к содержанию изомерного м-алкана в углеводородах различной молекулярной массы в общем сохраняется при некоторой тенденции к снижению с ростом алифатической цепи молекулы.
В сургутской нефти количественно определено содержание диметилдеканов, % •'
2,9-Диметилдекан 9,2
2,8-Диметилдекан 8,7
Общее содержание диметилдеканов составляет примерно половину суммарного количества изомерных метилундеканов и равно 0,25 % на нефть.
Для углеводородов С7 — С22 ромашкинской нефти соотношение суммарного содержания 2- и 3-метилалканов и н-алкана варьирует от 0,6 до 0,23, имея тенденцию к постепенному уменьшению с возрастанием молекулярной массы алкана.
Если суммировать результаты исследований индивидуального состава углеводородов нефти, то к настоящему времени число выделенных или надежно определенных составляет более 600. Лучше всего изучены нормальные алканы.
В нефти установлено присутствие всех н-алкаиов, от бутана (^кип 0,5 °С) до тритриаконтана СззН68 (^кип 475°С); некоторые из этих углеводородов выделены в чистом виде с чистотой выше 99 %. Содержание «-алканов в нефтях снижается с повышением молекулярной массы; количество высших гомологов — 0,1% и ниже.
Жидкие парафины Сю — Ci8, используемые для производства спиртов и белково-витаминных концентратов, получают из дизельных фракций методом карбамидной депарафинизации и адсорбционного извлечения на молекулярных ситах (цеолитах).
В недавно опубликованных работах по исследованию цикла-нов нафталанской нефти установлено, что они содержат от 1 до 8 циклов в молекуле; моно-, би-, три- и тетрациклаиы содержатся в количестве 87,5%. Молекулы цикланов содержат
1—4 метильные группы и в среднем один алкильный заместитель (С3 — С14) нормального или разветвленного строения, которые присутствуют примерно в равных количествах. Среди разветвленных заместителей преобладают алкилы изопренано-вого строения, а также алкилы с метилом в положении 2 (табл. 7.7).
Т а б л и ц а 7.7. Характеристика алкильных заместителей циклаиов различных фракций нэфталанской иефти
| О о о тГ 1 О ю со | 400—450 °С |
450-525 °С | ||||
|
Углеводороды | алкильный | число | алкильный | число | алкильный | число |
|
замести | СНз- |
замести | СНз- |
замести | СНз- | |
| тель | групп |
тель | групп |
тель | групп | |
|
Моноцикл ические | С]4 | 1—3 | _ |
_ | _ |
|
| Бицикл ические |
Сю | 1-3 | — | 2—3 | — |
— |
| Трицикл ические |
С5—Се | 2-4 | Се—Са |
2—4 | С12 |
3 |
| Тетр ациклические | Сз—С5 | 1—3 | Сз—С4 | 2—4 | Се—С7 | 2—4 |
|
Пентацикл ические |
С3 | 2—4 |
с8 | Сю |
2-4 | |
В табл. 7.8 приведено строение фрагментов алкильных заместителей цикланов нафталанской нефти.
Изопреноидные углеводороды нефти. В 60-х годах в нефти были обнаружены углеводороды изопреноидного строения. К алифатическим изопреноидам относятся алифатические политерпены, обладающие полиизопреновым скелетом, с характерным чередованием метальных заместителей в цепи через три метиленовые группы, которые можно рассматривать как продукты полимеризации изопрена. Принятое название «изопреноид-
Та блица 7.8. Массовое содержание структурных фрагментов заместителей циклаиов нафталанской иефти, %
| Строение основных фрагментов алкильных заместителей | 250—350 °С |
350—400 °С | 400-450 °С |
450-525 °С | > 525 °С |
|
СН3(СН2)„СН2- |
48 | 42 |
34 | 48 |
51 |
| (я = 4) | (п=4—5) |
1Г II СП 1 | (Л=6—7) (л-9—10) | ||
|
СНз-СНСН2СН2СН2 | 14 | 13 |
13 | И |
9 |
| | СНз | |||||
|
CH3-CH2—СНСН2СН2 |
7 | 6 |
7 | 6 |
3 |
| сн8 | |||||
| сн3снсн2-снсн2 | 12 | 14 |
18 | 8 |
6 |
| 1 СНз | |||||
|
сн3сн2сн2сн2сн 1 | 5 |
9 | 13 |
8 | 9 |
|
СНз | |||||
|
—СНСН2СН2СН2СН | 14 | 15 |
15 | 19 |
23 |
| 1 СНз СНз | |||||
ные углеводороды нефти» весьма условно отнесено к алканам разветвленного строения, являющимся гидрированными аналогами изопреноидов.
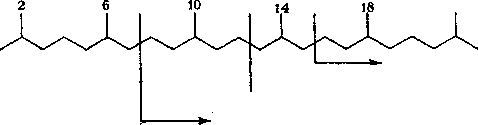
Строение изопреноидных углеводородов нефти состава Си — С20 может быть представлено в следующем виде:
К алифатическим изопреноидным углеводородам, найденным в настоящее время в нефтях, можно отнести 2,6-диметилалканы (Cs — С13), 3,7-диметилалканы (Сц, С12, Си), 2,6,10-триметил-алканы (Си—Ci8), 3,7,11-триметилалканы (Сш), 2,6,10,14-тет-раметилалканы (С19 — С25). Содержание изопреноидных углеводородов в нефтях колеблется в пределах 3—4 % на нефть, а иногда и выше.
Пристан и фитан впервые были обнаружены в иранской и восточно-техасской нефтях. Образование изопреноидных углеводородов нефти, как было указано в гл. 3, связывают с наличием в растениях фитола.
В парафинистых нефтях наблюдается преобладание при-стана и фитана над остальными изопреиоидами, а в нафтеновых (Аиастасиевско-Троицкое месторождение) — изопреноидов Си, С15, Cie (2,6,10-триметилуидекаиа, 2,6,10-триметилдодекана,
2,6,10-триметиЛтридекаиа). В иефти нафтенового типа месторождения Грязевая Сопка изопреноидные углеводороды практически отсутствуют.
Некоторые физические свойства изопреноидных углеводородов приведены в табл. 7.9.
Из табл. 7.10 видно, что в нефтях содержатся все семь изопреноидных углеводородов Си —С2о. Общее их содержание в нефти 1,5—2 %, содержание каждого углеводорода 0,2—0,5 %.
|
Углеводород | *кип ПР« 0,1 МПа, °С | *заст’ °С |
п20 nD | Р20, кг/м3 |
| (пересчитано) |
2.6.10-Триметилундекан (фарнезан)
2.6.10-Триметилдодекан
2.6.10-Триметнлтетрадекаи
2.6.10-Триметилпентадека н
2.6.10.14-Тетраметилпентадекан (п-ри-стан)
2.6.10.14-Тетраметилгексадекан (фи-тан)
236.2—237,5 253
285
300
331.2—332,5
<-100
<—90
<—80
<—70
<—70
1,4270
1,4335
1,4361
1,4400
1,4390
759.3
771.4 780,6
784.5
784.5
Таблица 7.10. Содержание изопреноидных нефтях, %
352,5—353,0 <—70 1,4420 793,5
углеводородов в различных
По данным П. И. Саиина
Восточно-
техасская
нефть
Иркутская
нефть
Ромашкинская
нефть
Углеводород
Было определено содержание изопреноидных углеводородов в четырех отечественных парафинистых нефтях (ромашкинской, грозненской, сургутской — Западная Сибирь и усинской — Ухта), при этом помимо указанных выше углеводородов С]4 — С2о определялись диметилзамещенные алканы Сц — С13: 2,6-диметилнонан, 2,6-диметилдекан, 2,6-диметилундекан. Общее содержание десяти углеводородов состава Сц — С20 (2,6-диметил-, 2,6,10-триметил- и 2,6,10,14-тетраметилзамещенных)
2-3%.
Для всех нефтей характерно, что среди изопреноидных алканов С2) — С25 в наибольшем количестве содержатся углеводороды состава C2i (табл. 7.11).
Изопреноидные алканы С9—С20 количественно определены в десятках нефтей. Обнаружение изопреноидных алканов С21 — С25 в нефтях позволяет считать реальным в нефтях присутствие более крупных по сравнению с фитаном молекул предшественников, например соланосана. В нефти были идентифицированы изопреноидные алканы регулярного типа строения
вплоть до Сад, т. е. изопреноиды, имеющие правильное (регулярное) чередование боковых метильных заместителей (2, 6, 10, 14, 18, 22 и т. д.), источником образования которых могут быть природные полиизопренолы. В последнее время в ряде нефтей обнаружены псевдо- и нерегулярные изопренаны, в частности в нефти полуострова Бузачи (месторождение Каражан-бас, скв. 105). Углеводороды с псевдорегулярной структурой Cj2 и Си (2,6-диметилалканы) не были обнаружены в нефти. В то же время присутствие 2,6,10-триметилалканов состава Сп и С1 э указывает на то, что сквалан участвует в образовании псевдорегулярных структур. К этой же мысли приводит и наличие в нефтях нерегулярных изопреноидов типа 2,6,10,15-тетра-метилалканов.
Ликопан также может рассматриваться как источник псевдорегулярных структур, таких, как 1,6,10,14-тетраметилалканы
Таблица 7.11. Содержание изопреноидных углеводородов в нефтях, %
| Месторождение |
||||
| Углеводород |
Сургут ское | Ромаш- кннское | Грознен ское (парафи- ннстая нефть) |
Гюргян- ское |
|
2,6-Диметилгептан (С9) |
3,80 | 3,66 | 5,74 | |
| 2,6-Диметилоктан (С,0) | 3,26 |
3,14 | 6,44 |
— |
|
2,6-Диметилноиан (Си) | 6,78 | 5,75 | 5,74 |
— |
|
3,7-Диметилнонан (С,,) |
3,26 | 1,30 |
1,19 | — |
|
2,6-Диметилдекан (С,2) |
2,44 | 2,62 |
1,43 | - — |
| 3,7-Диметилдекаи (С12) |
3,80 | 1,04 |
0,71 | — |
| 2,6-Диметилундекан (Си) |
6,49 | 6,80 | 6,20 |
— |
|
2,6,10-Триметилундекан (Сю) |
6,25 | 6,55 | 6,20 |
7,00 |
|
2,6-Диметилдодёкан (Си) |
Следы | Следы |
Следы | — |
| 3,7-Диметилдодекан (Си) | 4,06 | 2,62 |
0,71 | — |
| 2,6,10-Триметнлдодекан (Ci5) (фарне- | 7,58 |
10,40 | 7,40 |
13,20 |
| зан) 2,6,10-Трнметилтридекаи (Cie) |
7,05 | 11,70 |
8,60 | 13,20 |
|
3,7,11-Триметилтридекан (Cie) |
1,90 | 1,83 | 1,43 | — |
|
2,6,10-Триметилтридекан (С17) |
1,63 | 2,63 |
1,43 | 1,34 |
| 2,6,10-Триметилпентадекан (С]8) | 6,78 |
8,10 | 8,60 | 12,65 |
|
2,6,10,14-Тетраметилпентадекзи (при- | 9,48 | 9,40 |
19,40 | 22,75 |
| стан — Cjs) 2,6,10-Триметилгексадекан (С[9) 2,6,10,14-Тетраметолгенсадекан (фн- |
|Следы | Следы |
Следы | |
|
13,25 | 12,0 |
11,70 | 22,60 | |
| тан — C20) 2,6,10,14-Тетраметилгептадекан (C2i) | 3,52 |
4,45 | 2,86, |
4,30 |
|
2,6,10,14-Тетраметилдекан (Си) |
1,63 | 1,04 |
1,19 | 1,61 |
| 2,6,10,14-Тетраметилноиадекан (С23) | 2,03 | 1,30 |
1,43 | 1,35 |
| 2,6,10,14,18-Пеитаметилнона декан | 2,98 | 1,57 |
0,95 | — |
| (Ом) 2,6,10,14-Тетраметилэйкозан (См) |
_ | |||
| 2,6,10,14,18-Пентаметилэйкозан (С2в) | 2,03 |
2,35 | 0,95 |
— |
С22 и С24. Ниже приведена схема распада алифатической цепи углеводородов, показывающая возможные пути образования псевдорегулярных и нерегулярных изопреноидов.
Регулярная структура (2,6,10,14,18,22-гексаметилтетракозан):
нерегулярные изопреноиды
Сквалан (2,6,10,15,19,23-гексаметилтетракозан):
регулярные иэопреноиды 2,6- ; 2,6,10- ; 2,6,10,14- и т.д.
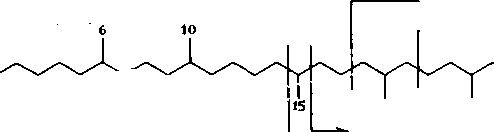
>- 2,6,10,13-
2,6,10,15,19- и т.д.
19 23
псевдорегулярные изопреноиды
2,6,10- (С17, С19)
Ликопан (2,6,10,14,19,23,27,31-октаметилдотриаконтан) :
нерегулярные “^изопреноиды
2,6,10,14,19-,
2,6,10,14,19, 23-и т.Д.
23 27 31
>. псевдорегулярные изопреноиды
¦>2,6,10,14- (С22>Сг4)
В шаимской и грозненской нефтях идентифицированы ликопан и его структурный изомер — изоликопан (2,6,10,14,17,21,25,-29-октаметил-14-этилтриаконтан). Обнаруженные нерегулярные структуры имеют число атомов углерода С20 и выше. Образование этих углеводородов возможно из сквалана (2,6,10,15-С2о—С24 и 2,6,10,15,19-Сгб — С29), а также из ликопана (2,6,10,14,19-С25 — С29 и 2,6,10,14,19,23-Сзо — С39).
В нефти Северо-толькииского месторождения (Западная Сибирь) обнаружена гомологическая серия изопренанов Cj9— С39, имеющих нерегулярное звено, образованное по типу «голова
к голове». Их образование происходило, по мнению Ал. А. Петрова, путем бактериального купелирования радикалов пристана и различных регулярных изопреноидов состава Сю — С20.
В последние годы описан новый тип изопренанов, имеющих в качестве заместителя достаточно длинную алифатическую разветвленную цепь. Углеводороды этого строения представлены соединениями С20, С25 и С3о и отличаются изопентильным звеном. Присутствуют они в нефтях и в осадках. Родоначальник этой группы — 2,6,10-триметил-7-(3-'метилбутил)додекан.
Методом хромато-масс-сиектрометрии П. И. Санин с сотрудниками доказали наличие в западно-сибирской нефти 2,6,10,Г4-тетраметил-7-(3-метилпентил)нонадекана, имеющего Т-образное строение и присутствующего в весьма высокой концентрации 0%).
Количественное определение методом ГЖХ содержания реликтовых углеводородов — нормальных (С12 — С35) и изопреноидных (Си — С25) положено Ал. А. Петровым в основу химической типизации нефтей (см. раздел 2.2). Дополнительной характеристикой является выявление группового состава основной фракции нефти 200—430°С, так называемого «тела нефти».
7.4. ТВЕРДЫЕ АЛКАНЫ
Алканы Сю и выше при нормальных условиях — твердые вещества, входящие в состав нефтяных парафинов и церезинов.
Деление твердых углеводородов на парафины и церезины было сделано на основании различия кристаллической структуры этих углеводородов, их химических и физических свойств. При одинаковой температуре плавления церезины отличаются от парафинов большими молекулярными массами, вязкостью и плотностью. Церезины энергично взаимодействуют с дымящей серной и хлорсульфоновой кислотами, а парафины с этими реагентами взаимодействуют слабо. Для исследования состава парафинов и церезинов была использована реакция нитрования. Азотная кислота с азоалканами образует третичные нитросоединения, а с н-алканами — вторичные нитросоединения. Методом нитрования показано, что в нефтяных парафинах содержится 25—35 % изоалканов, а в церезине — значительно больше. Появились сведения о присутствии в твердых углеводородах нафтеновых структур. Действительно, выделенные из петрола-тумов углеводороды имели более высокие значения показателя преломления, вязкости и плотности, чем парафины с той же температурой плавления.
Нефтяные парафины представляют собой смесь преимущественно алканов разной молекулярной массы, а основным компонентом церезинов являются нафтеновые углеводороды, содержащие в молекулах боковые цепи как нормального, так
| Нефть | р20, кг/м3 |
Содержание парафина, % |
| Охинская |
929,0 | 0,03 |
| Доссорская | 860,0 | 0,31 |
|
Артемовская | 924,0 | 0,62 |
|
Грозненская беспарафиниетая |
862,0 | 0,5 |
| Сураханекая масляная |
879,0 | 0,9 |
| Сагызекая |
853,0 | 1,1 |
| Ишнмбайская | 867,0 | 1,4 |
|
Раманыская парафинистая |
860,0 | 1,5 |
| Ново-степаиовская |
863,0 | 1,9 |
| Сураханекая парафинистая |
868,0 | 2,5 |
| Грозненская слабопарафннистая | 835,0 | 2,3 |
|
Туймазинская | 852,0 | 3,3 |
|
Сураханекая отборная |
853,0 | 4,0 |
| Шор-суская | 923,0 | 4,9 |
|
Зыхская | 828,0 |
7,5 |
| Грозненская парафинистая | 843,0 |
9,0 |
|
Гора-Гурская | 857,0 | 13,0 |
|
Озек-суатская | 822,0 | 20,0 |
и изостроения с преобладанием последних. Соединения, содержащие в длинной цепи алканового типа ареновые ядра, входят в состав церезинов в меньших количествах. Их соотношение определяется природой нефти, из 'которой выделен церезин.
Данные о содержании парафинов в нефтях приведены в табл. 7.12.
Плотность парафинов в твердом состоянии лежит в пределах от 865,0 до 940,0 в расплавленном — от 777,0 до 790,0 кг/м3. Растворимость парафина в органических веществах невелика, за исключением сероуглерода, в котором растворяется 12 ч. парафина на 100 ч. В легком бензине растворяется 11,7 ч. на 100 ч.
Температуры плавления индивидуальных компонентов парафина тем выше, чем больше их молекулярная масса. Самый низкоплавкий углеводород парафина — гексадекан (^Пл 18°С). Природный парафин из нефти представляет собой смесь нескольких углеводородов и поэтому не имеет четкой температуры плавления.
Установлено содержание н-алканов во фракции 350—540°С западносибирской нефти (табл. 7.13). Суммарное массовое содержание н-алканов С]8 — С« составило 4,3% на фракцию.
Наряду с н-алканами во фракциях с температурой кипения выше 300°С методом ГЖХ количественно определены 2- и 3-ме-тилалканы, присутствующие среди однотипных изомеров в наиболее высоких концентрациях.
В ряде нефтей Восточной Сибири найдена группа мономе-тилзамещенных алканов—12-метилалканы С24 — С30 и 13-ме-тилалканы С26 — С30. Концентрации углеводородов обеих серий равны. Их содержание в нефтях варьирует от 10 до 90 % от содержание н-алканов. Высокое содержание и особенности концентрационного распределения привели Ал. А. Петрова к мысли, что генезис этих углеводородов объясняется наличием в исходном нефтематеринском веществе циклопропанкарбоно-вой кислоты С25 (12,13-метиленте.тракозановой). Фактическая концентрация указанного реликта в других нефтях на порядок ниже, чем в нефтях Восточной Сибири.
Твердые парафины вырабатываются обезмасливанием избирательными растворителями гачей, получаемых при производстве масел или парафиновых дистиллятов из парафинистых и высокопарафинистых нефтей. Парафин-сырец указанных марок (В] — В4) характеризуется следующими показателями: содержание масла 1—2% температура плавления 52—55°С, температура вспышки в закрытом тигле 220°С. Парафин-сырец
Таблица 7.13. Содержание н-алканов во фракции 350—540 °С западносибирской нефти
| Алкан |
t °Г КИП’ |
Содержание на сумму алканов |
i-алканов, % на фракцию 350—540 °С |
| CieHse |
317,5 | 0,76 |
.0,03 |
| С19Н40 |
331,7 | 1,70 |
0,07 |
| 'G20H42 |
345,3 | 3,94 |
0,17 |
| С21Н44 |
368,4 | 6,71 |
0,29 |
| С22Н48 |
370,8 | 7,60 |
0,33 |
| С23Н48 |
382,7 | 7,36 |
0,32 |
| С24Н80 |
394,6 | 9,70 |
0,42 |
| iCaeHj2 | 405,3 | 8,11 |
0,35 |
| С*Ни | 416,7 | 10,02 |
0,43 |
| СгтНи | 427,3 | 7,58 |
0,32 |
|
ЮазНев | 437,5 |
6,46 | 0,28 |
| CssHeo | 447,5 |
5,74 | 0,25 |
| С30Н92 | 457,0 |
4,62 | 0,20 |
| iCs,HM | 466,3 |
3,82 | 0,16 |
| 'СзгНев | 475,4 | 2,83 | 0,12 |
| СмНи | 484,3 | 2,72 | 0,12 |
| С34Н70 | 492,7 | 2,04 | 0,09 |
| С35Н72 | 501,0 | 1,90 | 0,08 |
| СзвН74 | 509,3 | 1,75 | 0,07 |
| Сз7Н70 | 517,3 | 1,50 | 0,06 |
| С38Н78 | 524,9 | 1,10 | 0,05 |
| СзэНво |
532,6 | 1,12 |
0,06 |
| |С4оН82 | 539,8 | 0,95 |
0,04 |
подвергается дополнительной очистке на установках адсорбционной очистки или гидроочистки.
Характеристика товарных парафинов:
Температура плавления, °С
Содержание масла, % Глубина проникновения иглы, мм
| В, | в2 |
Вз | В4 |
| 50—52 |
52—54 | 54—56 |
56—58 |
| <0,8 | <0,5 | <0,5 | <0,5 |
|
<18 | <16 |
<14 | <13 |
Если обычный технический парафин, содержащий от 20 до 35 углеродных атомов преимущественно нормального строения, имеет температуру плавления, не превышающую 50—55°С, то температуры плавления разветвленных алканов той же молекулярной массы более низки. Молекулярные массы парафинов лежат в пределах от 300 до 450, а церезинов — от 500 до 750, что соответствует содержанию в цепи примерно от 36 до 55 углеродных атомов.
Церезины встречаются в природе в виде твердых углеводородов некоторых нафтеновых нефтей. Примесь церезина в парафинах практически невозможно выделить.
Церезин, выделенный из деасфальтированного концентрата туймазинской нефти, состоит в основном из циклоалканов и аренов с длинными алкильными цепями, образующих комплекс с карбамидом, а также с разветвленными цепями, не дающих комплекса. Циклоалканы этой нефти содержат в среднем два-три кольца в молекуле, а арены — от одного до трех колец.
Имеющиеся данные о химическом составе церезина недостаточны. Некоторые авторы считают, что церезины состоят преимущественно из высокомолекулярных н-алканов. Однако в ряде работ утверждается, что церезины представляют собой циклоалканы с длинными боковыми цепями. Кроме того, они содержат разветвленные алканы, незначительные количества н-алканов и очень мало алканоаренов. В частности, твердые углеводороды петролатума карачухуросураханской нефти состоят в основном из циклоалканов, содержащих в молекуле до трех колец. С повышением температурных пределов перегонки фракций пертолатума уменьшается содержание циклоалканов с неразветвленной боковой цепью и увеличивается число колец, приходящихся на одну молекулу.
Отличительный признак церезинов — мелкокристаллическая структура. Церезины состоят из более мелких кристаллов, чем парафин.
Физические свойства церезинов во многом сходны со свойствами нормальных углеводородов. Показатель преломления для церезинов значительно выше, чем для парафинов.
В химическом отношении церезины отличаются меньшей стойкостью, чем парафины.
Из нефтей, содержащих церезин, они выделяются при продолжительном стоянии в виде черных осадков, включающих еще минеральные примеси и смолистые вещества. Нефтяные воски содержат 10—50 % нормальных алканов и до 40—90 % аренов, циклоалканов и разветвленных алканов.
Таким образом, нефтяные парафины представляют собой смесь преимущественно н-алканов разной молекулярной массы, а основным компонентом церезинов являются нафтеновые углеводороды, содержащие в молекулах боковые цепи как нормального, так и изостроения с преобладанием последних. Твердые парафиновые и ароматические углеводороды входят в состав церезинов в меньших количествах, причем их соотношение определяется природой нефти, из которой выделен церезин.
7.5. СВОЙСТВА АЛКАНОВ
Данные о физических и химических свойствах алканов приведены в литературе. Здесь описаны лишь некоторые, имеющие особенно важное значение в нефтехимических процессах.
Физические свойства. Алканы насыщены водородом и по сравнению с углеводородами других классов имеют минимальные значения плотности и показателя преломления, что используется в аналитических целях.
Нормальные углеводороды, молекулы которых лучше упаковываются в жидкрй фазе, имеют наивысшие температуры кипения и наибольшую плотность, а наиболее разветвленные — низшие значения температуры кипения и плотности (табл. 7.14).
Твердые алканы кристалличны. На температуру плавления в значительной степени влияют геометрические факторы упаковки молекул в кристаллической решетке. Чем симметричнее молекула, тем легче и прочнее ее упаковка в кристалл и тем выше'температура плавления.
Углеродный атом в алканах удерживает связанные с ним атомы по осям правильного тетраэдра. Из данных рентгеноструктурных исследований известно, что в алканах центры атомов углерода расположены на расстояниях 0,154 нм, а расстояние от центра атома углерода до центра атома водорода равно 0,11 нм. Тем не менее, поскольку поворот вокруг связи С—С совершается легко и почти без затраты энергии, то углеродная цепь может принимать различные конформации, вплоть до спиральной.
Углеводород
Метан
Этан
Пропан
Бутан
Изобутан
Пентан
2-Метилбутан
2.2-Диметил пропан Г ексан
2-Мет илпентан
3-Метилпентан
2.3-Диметилбутан Гептан
2-Метил гексан
3-Метилгексан
2.2-Диметилпентан
2.3-Днметилпентан
2.4-Диметилпентан
3.3-Диметилпентан З-Этилпентан
2.2.3-Трнметилбутан Октан
2-Метил гептан
2.2.4-Триметилпентаи (изооктан)
Нонан
Декан
Ундекан
Додекан
Тридекан
Тетрадекан
Пентадекан
Гексадекан (цетан)
Гептадекан
Октадекан
Нонадекан
Эйкозан
Генэйкозан
Доказан
Трикозан
Тетракозан
Пентакозан
Гексакозан
Гептакозан
Октакоза н
Нонакозан
Триаконтан
Пентатриаконтан
Пентаконтан
| t °с 'пл- ^ | t кип1 |
°с | рг0, кг/м3 | 20 nD | |
| — 182,6 | —161 |
6 | 0,3020 ( — 100 |
°С) | |
|
—183,6 | —88 |
6 | 0,5612 ( — 100 |
°С) | _ |
|
— 187,7 | —42 |
3 | 0,5794 (—40 ° | С) | _ |
| — 138,3 | —0 | 5 | 0,5789 |
_ | |
| — 159,6 | — 11 | 7 |
0,5593 | _ |
|
| — 129,7 | 36 | 08 | 626,2 |
1,3577 | |
| — 159,6 | 28 | 0 | 620 |
1,3579 | |
| —16,6 |
9 | 5 |
592 | 1,3513 |
|
| —95,3 | 68 | 7 | 664,7 |
1,3750 | |
| — 153,7 | 60 | 2 | 654,2 |
1,3715 | |
| — 118 |
63 | 2 |
664,7 | 1,3765 |
|
| —128,4 | 58 | 0 | 661,8 |
1,3783 | |
|
-90,6 | 98 |
4 | 683,7 |
1,3876 | |
| — 118,9 | 90 | 1 |
677,5 | 1,3877 |
|
| — 119,4 | 91 | 9 | 687,0 |
1,3887 | |
|
—123,8 | 79 |
2 | 673,0 |
1,3821 | |
| — |
89 | 8 |
695,4 | 1,3920 |
|
| —119,5 | 80 | 5 | 672,7 |
1,3814 | |
|
—135,0 | 86 |
1 | 693,3 |
1,3903 | |
| —93,4 | 93 | 5 |
697,8 | 1,3934 |
|
| —25,0 | 80 | 9 | .689,4 |
1,3894 | |
|
—56,8 | 125 |
6 | 702,8 |
1,3976 | |
| —109,5 | 117 | 7 |
696,6 | 1,3947 |
|
| —107,4 | 99 | 2 | 691,8 |
— | |
|
—53,7 | 150 |
7 | 717,9 |
1 4056 | |
| —29,8 | 174 | 0 |
730,1 | I 4120 |
|
| —25,7 | 195 | 8 | 740,4 |
1 4190 | |
|
—9,65 | 216 |
2 | 748,9 |
1,4218 | |
| -6,2 |
234 | 0 |
756,0 | * — |
|
| 5,5 | 252 | 5 | 763,0 |
__ | |
|
10,0 | 270 |
5 | 768,9 |
— | |
| 18,2 |
287 | 5 |
773,0 | — |
|
| 22,5 | 303 | 0 | 758,050 | — | |
|
28,0 | 317 |
0 | 7625° |
— | |
| 32,0 |
330 | 0 |
766,050 | — | |
| 36,4 |
344 | 0 |
769,050 | — | |
| 40,4 |
356 | 0 |
775,040'3 |
— | |
| 44,4 |
368 | 0 |
778,044,4 | _ | |
| 47,7 |
380 | 0 |
799,948 | — | |
| 50,9 |
389 | 2 |
- | — | |
| 54,0 | 405 |
0 | 779,0 | — | |
| 60,0 | 418 | 0 |
779,0 | — |
|
| 59,5 | 423 | 0 |
779,659'5 |
— | |
| 65,0 |
446 | 0 |
779,0 | — |
|
| 63,6 | 480 | 0 | - |
— | |
|
70,0 | 461 |
0 | _ |
— | |
| 74,7 |
500 |
78274 | — | ||
| 93,0 |
607 | — |
— |
||
Температура плавления зависит не только от молекулярной массы, но и от строения алканов. Наибольшее понижение температуры плавления наблюдается с приближением заместителя к середине цепи.
Основные реакции алканов. Алканы достаточно инертны ко многим химическим реагентам. Их химические свойства излагаются в курсах органической химии. Здесь рассматриваются в основном реакции, использующиеся в нефтепереработке. Наибольший интерес с этой точки зрения представляют реакции окисления, термического и термокаталитического превращения (см. гл. 12 и 13) и галогенирования.
Окисление. Механизм. Со времени опубликования пер-оксидной теории процессов окисления Баха — Энглера на основе работ Н. Н. Семенова, Н. М. Эмануэля и большого числа других исследований установлен принципиальный механизм реакций окисления углеводородов (RH) и других органических соединений.
Схема включает следующие элементарные стадии: зарождение, продолжение, разветвление, обрыв цепи, а также молекулярный распад гидропероксида с образованием разнообразных продуктов окисления.
Зарождение цепи. Зарождение цепи в отсутствие катализирующих добавок происходит при атаке кислородом молекулы углеводорода по реакциям:
RH + Cb —* R • +Н02;
2RH + 02 —> 2R • + Н2О2.
Энергия разрыва связи —С—н в зависимости от природы
I
соединения изменяется от 290 до 420 кДж/моль. Зарождение цепи по тримолекулярному механизму энергетически более выгодно, чем по бимолекулярному, если энергия разрываемой
связи —С—Н меньше, чем 380 кДж/моль. Например, при I
окислении декана, тетралина, циклогексана зарождение цепей осуществляется по тримолекулярной реакции. В случае окисления метилэтилкетона и этилового спирта при 145—200°С и давлении 5 МПа зарождение цепей происходит по биомолеку-лярной реакции. В некоторых случаях процесс зарождения цепей оказывается гетерогенным и идет на стенках реакционного сосуда.
Свободные радикалы (инициирование) могут образоваться также за счет воздействий на систему энергии извне (фотохимическое инициирование, действие ионизирующих излучений, применение фотосснсибилизаторов).
В качестве инициаторов в реакциях окисления углеводородов могут быть использованы соединения металлов переменной валентности, например ионы Мп3+:
RH + Мп3+ —v R . + Мп2+ + Н+.
Продолжение цепи. Образовавшийся в системе за счет процессов зарождения или вырожденного разветвления цепи свободный радикал R- начинает цепь окислительных превращений:
Присоединение радикала R- к кислороду происходит очень быстро и практически без энергии активации (константа скорости реакции Ю7—108 л/(моль-с)). Затем при взаимодействии радикала R02- с углеводородом образуется гидропероксид. Энергия активации этой реакции изменяется в диапазоне 17—68 кДж/моль.
Свободная валентность пероксидного радикала может насыщаться за счет отрыва атома Н от молекулы или от самого радикала. При этом происходит внутримолекулярная изомеризация с образованием радикала, содержащего гидропероксид-ную группу и свободную валентность у другого атома углерода.
Реакция пероксидного радикала со связью —С—н в у- и |J-no-
I
ложениях не имеет пространственных затруднений и должна протекать сравнительно легко.
Радикалы RCb- по мере накопления продуктов реакции реагируют не только с исходным веществом, но и с более реакционноспособными продуктами его превращения — гидропероксидами, спиртами, кетонами, сложными эфирами.
Пероксидный радикал может не только отрывать атом водорода от кетопроизводных, но и присоединяться по карбонильной группе:
О
OOR
О
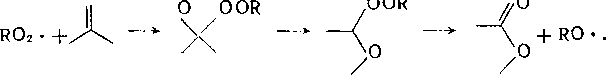
Наряду с основной реакцией продолжения цепи в некоторых случаях при жидкофазном окислении протекает также изомери-
I I
зация пероксидпых радикалов с разрывом связи —С—С—
I I
и образованием карбонильных соединений и алкоксильных радикалов:
Скорость окисления углеводородов (№ окисл) в начальный момент подчиняется уравнению:
Гокисл = ^ [RH] VW7/V2*e,
где &2 — константа скорости продолжения цепи, л/(моль-с); kB — константа скорости обрыва цепи, л/(моль-с); [RH]—концентрация субстрата, моль/л; Wt — скорость инициирования, моль/(л-с).
В результате влияния на процесс образующихся продуктов окисления приведенная формула для глубоких стадий окисления становится непригодной.
Вырожденное разветвление цепей. В развившемся процессе окисления образование радикалов осуществляется по реакции вырожденного разветвления цепей с участием гидропероксида. Гидропероксид распадается не только по мономолеку-лярной реакции
ROOH —> RO • + • ОН,
но и при бимолекулярном взаимодействии гидропероксида с ис1 ходным углеводородом:
ROOH + RH —> R0-+R-+H20.
Механизм разветвления цепей на глубоких стадиях реакции сложнее, так как продукты окисления (спирты, кетоны, кислоты) принимают участие в образовании радикалов через стадию промежуточных комплексов:
ROOH + nRCOOH [ROOH .. • nRCOOH] —v RO • + • ОН + nRCOOH.
Наряду с радикальным распадом гидропероксидов может протекать и молекулярный их распад (ROOH, молекулярные продукты окисления), приводя к торможению процесса.
Обрыв цепей в жидкофазном окислении. Гибель свободных радикалов может происходить при взаимодействии свободного радикала со стенкой реактора и при квадратичном обрыве. Вследствие высокой вязкости среды в жидкой фазе диффузия радикалов к стенке затруднена. В жидкофазных процессах происходит в основном квадратичный обрыв цепей:
R • + R • —> R • + RO2 • —> RO2 • "Ь RO2 •
Молекулярные продукты.
Эти реакции протекают с энергией активации в 4— 8 кДж/моль. Линейный обрын цепи характерен для действия ингибиторов — фенолов, амииов и др.
Схема жидкофазного окисления в присутствии катализаторов значительно отличается от схем некаталитического окисления.
Инициирование цепей на начальной стадии окисления в присутствии соединений металлов переменной валентности (ML) может протекать при взаимодействии катализатора с углеводородом:
RH + M(ra-1)+L* —> Mra+L*_, + R • +HL.
Лимитирующей стадией процесса является перенос элек-
I
трона, а не разрыв связи —С—Н.
I
В присутствии кислорода зарождение цепей протекает по схеме:
- м(га+1)+ +L*OH + RO • ,
Оо + Mn+LJC [Mn+L°+ ... о|~]
_ м(га+1)+ +UOOH+ R • .
Весьма важную роль в реакции каталитического окисления играют гидропероксиды. Взаимодействие гидропероксида с металлом постоянной или переменной валентности может приводить или к ускорению (чаще всего), или к торможению окисления.
В большинстве случаев с ростом концентрации гидропероксида порядок реакции стремится к нулю, что объясняется промежуточным комплексообразованием:
Ki
nROOH -f тЖп+ nROOH • mW1*.
Образующийся комплекс неустойчив и распадается на конечные продукты реакции:
к
nROOH ¦ тЖп* —v —* RO ¦ + ОН~ + М(п+1)+ + (л — 1) ROOH+ (т- 1) Мге+;
К
n,ROOH + m,M('l+1)+ 5=± n,ROOH • miM(n+1)+ —>
—> ROO • +Н+ + Мге+ + (л, - 1) ROOH -f- (гп\ - 1) М(п+1)+ •
Участие соединений металлов переменной валентности в реакциях продолжения и обрыва цепей можно представить следующей схемой:
ROa+ML [ROj-...-ML] —>
• R02ML (обрыв цепи);
•кетон + MLOH —> МЬОНиеакт + R'H —> ¦—*¦ R' -+H20 + ML (продолжение цепи);
N'4C=C'^
RO ¦ +MLO->¦ \с—С< + ML. •
Y
На глубоких стадиях окисления накапливаются спирты, кетоны, кислоты. Они взаимодействуют с катализатором и являются дополнительным источником свободных радикалов (разветвление цепи):
f R'CHO
M(«+i)+Lx+ROOH ] °Н
t;
R'CHsCOR" —» R'CH = CR"
.R'COOH
RO • +Mra+1L*_„
Окисление легких алканов. В промышленности окисляют главным образом метан, пропан и бутан. Скорость окисления возрастает от метана к бутану. Трудность регулирования процесса связана с тем, что продукты окисления (спирты, альдегиды и кетоны) окисляются легче, чем исходное сырье.
Процессы окисления газообразных углеводородов можно разделить на сравнительно низкотемпературные (150—250°С) и высокотемпературные (400—600°С). В этих условиях с применением избытка углеводорода и малого времени пребывания продуктов в реакционной зоне удается направить процесс в нужную сторону.
Для преимущественного получения формальдегида в качестве катализаторов применяют соединения, марганца или меди:
катализатор
СН4 + 0,50а -> СНзОН — 129,8 кДж/моль,
катализатор
СНзОН + 0,502 -> НСНО + Н20 - 147,4 кДж/моль.
При окислении метана в присутствии платины или палла
дия получается преимущественно муравьиная кислота:
катализатор
нсн0 + 0,502 --> НСООН-275,1 кДж/моль,
катализатор
НСНО + 0,5О2 ->- С02 + н20 — 242 кДж/моль.
Некаталитическое окисление метана при атмосферном давлении приводит в основном к образованию оксида углерода(II) через стадию образования метанола:
о2
СНзОН —* С0 + 2Н20.
Механизм неполного окисления метана при 400°С и атмосферном давлении характеризуется следующими реакциями: СН4 —> СНз • + Н •;
СНз * 02 ¦—СН3ОО •*,
СНзОО • + СН4 —* СНзООН + СНз •;
СНзООН —* НСН0 + Н20;
СН20 + 02 —S- НСО • +Н02 • — 134 кДж/моль;
СНэО-+СН4 —> СНзОН + СНз-;
НО • + СН4 —>- СНз • + Н20 и т. д.
Скорость зарождения цепей по реакции формальдегида с кислородом при 425°С на пять порядков больше, чем при реакции метана с кислородом:
СН4 + Ог —* СНз • + Н02 •;
При 340 °С, давлении 10,6 МПа и соотношении метан: кислород 9: 1 конверсия метана составляет 22%; выход метанола 17%, формальдегида 0,75%. Образуются также диоксид углерода и вода.
Преимущественное образование метанола объясняется протеканием следующих бимолекулярных реакций в объеме: СНзОО • -|- СН4 —>- СНзОН + СНзО -;
СНзО-+СН4 —>¦ СНзОН + СНз-.
При низких давлениях процесс протекает в основном на поверхности реакционного сосуда и образуется формальдегид: СНзОО • —¦> НСНО + • ОН.
Окисление метана с 3—13% 02 при 350°С, 15—20 МПа на медном или серебряном катализаторе позволяет достичь 75 %-ной конверсии его в метанол (конверсия метана «5%).
В промышленной практике окисление алканов в газовой фазе ведут в условиях значительного избытка углеводорода без катализаторов под давлением при 330—370°С. Затем продукты окисления быстро охлаждают (закалка), впрыскивая воду. Кислородсодержащие соединения абсорбируются водой, а непрореагировавшие углеводороды возвращают в цикл окисления.
|
Продукт | Объемное соотношение пропан : воздух | ||||
| 1 : 20 | 1 : 15 | 1 : 3,6 | 1 : 1,25 | 1 : 0,15 | |
| Альдегиды |
12,5 | 6,6 |
12,0 | 16,1 |
16,7 |
| Спирты | 17,3 | 25,7 |
23,0 | 33,1 |
34,5 |
|
Изопропанол | 2,7 |
6,9 | 5,2 |
5,2 | 14,4 |
| Ацетон | 1,2 |
1,4 | 1,3 |
0,3 | 7,4 |
|
Кислоты | 13,9 |
13,4 | 15,2 |
8,9 | 12,5 |
| Всего продуктов конденсации | 47,6 | 56,0 |
56,7 | 63,6 |
85,5 |
| Диоксид углерода | 31,5 |
25,0 | 22,1 |
10,5 | 6,5 |
| Оксид углерода |
20,9 | 19,0 |
21,2 | 25,9 |
8,0 |
Соотношение углеводорода и воздуха существенно изменяет выход целевых продуктов (табл. 7.15). Концентрация кислорода составляет 4—5%.
Снижение температуры окисления увеличивает выход кислородсодержащих соединений, но при этом резко уменьшается скорость реакции. Увеличение давления приводит к возрастанию скорости окисления и выхода спиртов. Время пребывания реакционной смеси в реакционной зоне 1,0—1,5 с. При увеличении времени пребывания выход кислородсодержащих соединений снижается за счет более интенсивного образования диоксида углерода.
Окисление бутана и бензинов. В США получают более 100 тыс. т/год ацетальдегида окислением пропана и бутана при общем объеме производства ацетальдегида ~ 1 млн т. Большой интерес представляют процессы окисления пропана и бутана при 150—200 °С в жидкой фазе.
Окисление бутана в нашей стране в промышленных условиях осуществляют в растворе уксусной кислоты в присутствии кобальтовых или марганцевых солей (0,3 % катализатора) при 165—200 °С и 6—8 МПа при непрерывной подаче реагентов. Из 100 ч. (по массе) бутана получается около 80—100 ч. уксусной кислоты, 12,6 ч. метилацетата, 7,6 ч. этилацетата и 6,6 ч. метилэтилкетона. В меньших количествах образуются ацетон, ацетальдегид, диацетил, бутилацетат, муравьиная кислота, метиловый, этиловый, бутиловый спирты и бифункциональные соединения.
В 1956 г. Н. М. Эмануэль на примере окисления бутана показал, что с использованием газового инициирования (1 % N02) можно осуществить окисление ожиженных газов при температуре несколько ниже критической (153°С, давление 0,3— 0,6 МПа).
Механизм образования продуктов окисления бутана определяется двумя направлениями реакции продолжения цепи:
взаимодействием R02- с бутаном и распадом R02- с образованием продуктов, содержащих в молекуле меньшее число атомов углерода, чем в исходной молекуле:
С4Н10 + 02 —> С4Н9 • + НО* •;
С4Н8 - + 0 = 0 —>- С4Н900 •;
С4Н„00 • + С4Н10 —> С4Н9ООН + С4Н9 •;
СНзСШСН (ООН) СНз —-> СНзСШСОСНэ + Н20;
СН3СН2СОСН3 СНзСН(ООН)СОСНз —> СН3СНО + СНзСООН.
Ацетальдегид сразу же окисляется до уксусной кислоты.
Для пероксидного радикала С4Н9ОО возможен распад с образованием ацетальдегида, ацетона, метанола и этанола. Метилацетат и этилацетат образуются в результате этерифика-ции соответствующих спиртов уксусной кислотой:
-СНдСН—СН2СН3 —> СНдСНО + снасн„о •
- СНд-?-СНСН2СН3 —- СН3СН2СНО + сн3о*
СН3СНСН2СНа
ОО-
-снзснсн24 снз —» СН3СОСН3 + СНэО* о4-о'"
Радикалы СН30- и СН3СН20- продолжают цепь, реагируя с исходным бутаном:
СНзО • + С4Н10 —^ СНзОН + С4Н„ •;
СНзСНаО • + С4Ню —> СН2СН2ОН + С4Н9 •.
Для получения уксусной кислоты необходим бутан чистотой 98—99 Наличие в бутане примеси изобутана приводит к образованию ацетона и метилацетата.
Из пропана образуются ацетон и метилацетат. Введение воды в зону реакции способствует возрастанию селективности процесса по уксусной кислоте, хотя процесс и замедляется.
Разработано жидкофазное окисление бензинов. Сырьем для производства низкомолекулярных карбоновых кислот могут служить фракции прямогонных бензинов и рафинатов рифор-минга. Окислению подвергается широкая фракция бензина, перегоняющаяся в пределах 30—115°С, при этом до 80% сырья перегоняется до 75—80 °С. По сравнению с окислением бутана в этом процессе увеличивается выход уксусной и пропионовой кислот.
бензина, кг на 1 м3 реактора:
Головная
Бутан фракция
бензина
Окисление высших алканов в спирты. Для получения эффективных синтетических моющих средств большое значение имеют алкилсульфаты, приготовляемые, в частности, на основе высокомолекулярных первичных спиртов.
В России А. Н. Башкировым разработан метод получения смеси первичных и вторичных спиртов окислением жидких алканов в присутствии борной кислоты. Для окисления используют смесь жидких нормальных алканов, выделенную из фракции дизельного топлива депарафинизацией при помощи мочевины.
Окисление проводят азотно-кислородной смесью, содержащей 3—4,5 % кислорода, в присутствии 4—5 % борной кислоты (в расчете на массу исходных углеводородов).
Борная кислота реагирует с образующимися спиртами, связывая их в эфиры, и защищает от дальнейшего окисления: ЗС12Н25ОН + В(ОН)з —> (С12Н250)з В + ЗНзО.
Спирты, полученные окислением фракции синтина (С15—Cis, tKKa 275—320 °С), представляют собой смесь изомеров, состоящую в среднем на 87 % из вторичных и на 13 % из первичных.
В широкой фракции спиртов прямого окисления парафина содержатся спирты С9Н19ОН — С21Н43ОН, но основное количество (70—80 %) составляют спирты С14Н29ОН — С18Н37ОН. Среди них 17—25 % первичных спиртов и 75—83 % вторичных.
Окисление твердых алканов в карбоновые кислоты. Окисление алканов кислородом воздуха в присутствии катализаторов проводят при 100—130°С. При этом наряду с карбоновыми кислотами образуются гидропероксиды, спирты, кетоиы, сложные эфиры и другие полифункциональные продукты превращения (гидрокси-, кето-, дикарбоновые кислоты, лактоны, кетоспирты, дикетоны).
В молекуле нормального алкана окисляются с равной ве-
ции соответствующих спиртов уксусной кислотой: —С—Н-связи,
I
Первичным молекулярным промежуточным продуктом окисления является вторичный гидропероксид:
оа RH
R'CHaCHCHaR" —> R'CHjCHCHjR" ~ >
R'CHa - CHCH2R" + R 'CH2CHCH2R". doH
Свободная валентность радикала R02- насыщается не только путем отрыва атома Н от другой молекулы углеводорода, но и в результате изомеризации в основном в Р- и y-по-ложение к пероксидной группе:
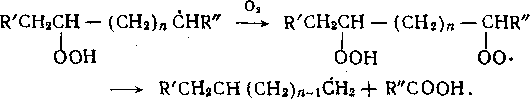
I
ООН
Внутримолекулярные реакции приводят к образованию продуктов непосредственно из радикалов RCV, минуя стадию образования гидропероксида:
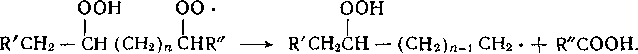
Именно таким путем образуется значительное количество кислот при некатализированном окислении к-алканов.
Распределение кислот по молекулярной массе значительно отклоняется от известного механизма Лангенбека — Притцкова (a-механизм, согласно которому протекает практически только разрыв С—С-связи в a-положении к первично образующейся пероксидной группе).
Накапливание в оксидате низкомолекулярных кислот (муравьиной и уксусной) аномально больших количеств связано с тем, что кислоты образуются не только по а-, но и по §- и у-механизмам (изомеризация).
При распаде вторичных гидропероксидов образуются спирты и кетоны, сохраняющие алифатическую цепь исходного углеводорода. Данные гидропероксиды разлагаются по мономо-лекулярной и бимолекулярной реакциям, происходит также их индуцированное разложение под действием свободных радикалов) :
о
II
R'CCH,^.
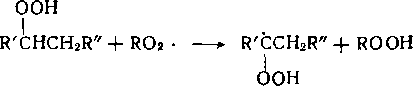
ОО ¦
О, | RH
R'CH (ОН) R" —*¦ R'C(OH)R" —> R'C(OH)R" —»
ООН
I
' —> R'C(QH)R" [^C-O + HjO*.
Кетоны реагируют с кислородом легче, чем исходные алканы. Атака кислорода направлена на ослабленную а—С—Н-связь кетона.
Образующийся а-кетогидропероксид распадается на дике-тон, кислоту и альдегид:
Изомеризация а-кетогидропероксидного радикала приводит к кислоте и лактону:
ООН о
00 •
о
ООН
![]()
-НгО
о
![]()
О—I
О ООН
—*0 0
II
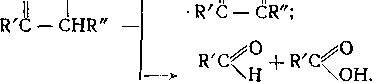
При окислении кетонов разрываются С—С-связи в а-, |3-, Y-положениях в карбонильной группе и образуются кислоты от
С2 ДО- Сл—2*
Синтетические жирные кислоты (Сю—С20) имеют разнообразные области применения, среди которых наиболее важные — производство мыла, пластичных смазок, пластификаторов, эмульгаторов, стабилизаторов, ингибиторов коррозии. Выход отдельных фракций кислот зависит от состава и качества твердых н-алканов, технологии окисления и разделения целевых кислот.
Смеси твердых алканов с числом углеродных атомов в среднем от 20 до 40 окисляют для получения карбоновых кислот, содержащих главным образом от 10 до 20 углеродных атомов (табл. 7.16).
В последнее время для получения СЖК применяют твердые (/„л 40—48 °С) и жидкие (/пл 24—26 °С) алканы.
|
Парафин | Интервал темпера тур |
Среднее число атомов углерода в молекуле | Выход кислот в расчете на сырье, % | ||||
|
ИСХОДНОГО алкана, °с |
исход ного алкана |
кислот | Сб Со |
Сю—Cia | Си—Cjo |
> Cji | |
|
Синтетический |
275—390 | 19,4 | 13,0 14,5 |
22,6 | 46,5 |
16,9 | 13,9 |
| Дрогобычского нефтеперерабатывающего завода |
350—370 | 28,1 |
12,2 | 44,7 |
17,4 | 25,7 | |
| Новокуйбышевского неф |
370—470 | 30,7 |
14,8 | 11,0 |
39,2 | 22,2 |
27,6 |
|
теперерабатывающего завода | 405—494 |
33,0 | 17,0 |
7,5 | 31,2 |
20,2 | 41,1 |
, В качестве катализаторов применяют смесь производных марганца и натрия (или калия). В частности, широкое применение нашел катализатор, получаемый из сульфата марганца и кислот Ci—С4, который удается регенерировать. Удобен также катализатор, содержащий марганцевые и натриевые мыла СЖК (от С5 до С2о).
Согласно современным представлениям основная масса продуктов окисления алканов в присутствии K(Na) — Мп-кага-лизатора образуется параллельными путями из пероксидных радикалов, минуя стадию гидропероксида. В данном случае регулирующее действие катализатора объясняется его способностью реагировать с пероксидными радикалами, не обрывая цепей, т. е. с участием металла в продолжении цепи. Но эта схема не объясняет всех особенностей каталитического окисления углеводородов.
Галогенирование. Реакция галогенирования алканов относится к радикально-цепным. Различают термическое, фотохимическое и инициированное галогенирование. Возбужденный свободный атом галогена способен замещать атом водорода в н-алкане.
стенка; 250—500 °С q2 -* Cl • + Cl
Продолжение цепи осуществляется с помощью атома хлора, образовавшегося на стадии зарождения цепи:
С1 ¦ + RH —»• R ¦ +НС1;
R ¦ +С12 —+¦ RCI + CI ••
Длина реакционной цепи при хлорировании технических продуктов составляет десятки или сотни звеньев.
Обрыв цепи при хлорировании в газовой фазе обычно протекает на насадке или стенке реактора:
стенка
01 . »- С1адс.
В жидкой фазе при хлорировании углеводородов, как правило, происходит квадратичный обрыв цепи на свободных радикалах:
—* RCH2CH2CH2CH2R;
2RCH2CH2 —
—* RCH = СН2 + [RCH2CH3-
При реакциях с хлорпроизводными обрыв происходит на радикалах хлора или перекрестным путем:
2С1 • —^ Cl2; R • + С1 • —* RC1.
При галогенвровании парафиновых углеводородов важное значение имеет направление атаки реагента, приводящее к образованию изомерных алкилгалогенидов. Состав изомеров определяется относительной подвижностью различных атомов водорода. Реакционная способность атомов водорода зависит от их положения — при первичном, вторичном или третичном атоме углерода, изменяясь в ряду: трет- > втор- > пере-. Повышение температуры приводит к сближению реакционных способностей различных атомов водорода.
Важное практическое значение имеют хлорпроизводные метана и парафина. Метилхлорид и метиленхлорид получают хлорированием метана при ^00—550°С, а хлороформ и тетрахлорид углерода — фотохимическим хлорированием метиленхлорида в жидкой фазе. Этилхлорид получают хлорированием этана в газовой фазе при 450—500 °С. При газофазном хлорировании технической смеси н- и изопентана образуется смесь семи изомеров монохлорпентана общей формулы C5H11CI, используемая для производства смеси изомеров амиловых спиртов (пентазол). Продукт частичного замещения водорода хлором во фракции алканов Сю—Си используют в производстве поверхностно-активных веществ типа алкиларилсульфонатов:
AICI3 HiSO,
C12H25CI -Ь С„Нв ->¦ С12Н25 — CeHs ->¦
-HCI -н,о
NaOH
—> C12H25CeH«S03H -> С12Н25- CeH«-S03Na.
-HjO
При хлорировании парафина, которое проводят в жидкой фазе при 70— 120°С, получают смесь, содержащую хлора от 40 (хлорпарафин-40) до 70 % (хлорпарафин-70):
Cl, 5C!j 16С1,
СпНгп -> C„H2n-iCI--> CnH2«-eCle--> СлНгл-заСЬа.
-HCI -5HCI -16HCI
Монохлорпарафииы используют для синтеза присадок к смазочным маслам.
Хлорпарафин-40 используют в качестве пластификатора и для пропитки бумаги и тканей с целью повышения их огне-
стойкости. В технике кроме хлоруглерода нашли широкое применение фторпроизводные — продукты исчерпывающего фторирования некоторых нефтяных фракций. Их используют в качестве термически и химически стойких смазочных масел и гидравлических жидкостей. Фторпроизводные метана и этана — хладоны — используют в качестве хладагентов и получают в промышленности замещением атомов хлора на фтор в хлороформе, тетрахлориде углерода, тетра-, пента- и гексахлорэтане. Для хладонов установлены сокращенные названия, соответствующие их составу — хладон-12, хладон-113 и т. д. Последняя цифра указывает число атомов фтора, вторая цифра справа на единицу больше числа атомов водорода, а первая слева — на единицу меньше числа атомов' углерода в молекуле. Наибольшее значение в технике имеют хладон-12, хладон-22 и хладон-113.
Хлорирование метана проводят в промышленном масштабе. Хлорируются и бромируются все алканы. Широко используют такие продукты хлорирования, как метил- и метиленхлорид, хлороформ, тетрахлорид углерода. Иодировать предельные углеводороды не удается. Однако можно осуществлять их прямое фторирование.
Сульфирование. Олеум при нагревании медленно сульфирует изоалканы:
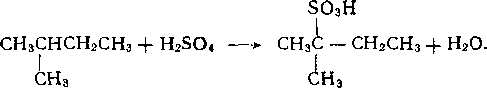
Сульфохлорирование. В 1936—1940 гг. были открыты две важные реакции насыщенных углеводородов — сульфохлорирование и сульфоокисление.
В промышленности эту реакцию используют при сульфохло-рировании когазина (высококипящая фракция синтина). Ниже приведен механизм сульфохлорирования:
фотолиз
2CI •;
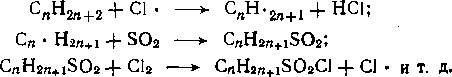
Сульфохлориды из когазина используют для получения моющих средств. Для этого их действием щелочи переводят в соли сульфокислот Aik — SOzONa.
Алифатические сульфохлориды реагируют со спиртами, фенолами, аминами и дают сложные эфиры и амиды, применяемые в качестве пластификаторов и промежуточных веществ.
Сульфоокисление. Реакция сульфоокисления необратима, сильно экзотермична и ускоряется под влиянием освещения или инициаторов:
RH + SO2 + 0,5O2 —> RSOaOH.
Механизм сульфоокисления алканов состоит из следующих стадий:
R • +S02 —>• RS02 •;
RSO2 • + Ог —> RSO2OO •;
RS0200- + RH —* RSO2OOH + R •;
RSChOO • + SO2 + Н2О —* RSChOH + H2SO4.
При введении воды на образование серной кислоты расходуется около половины всего диоксида серы. В случае низших гомологов после первичного облучения процесс протекает самопроизвольно, а при реакции с высшими углеводородами даже без введения воды необходимо постоянное освещение реакционной массы.
Реакционная способность различных атомов водорода при сульфоокислении изменяется так же, как при сульфохлориро-вании: втор- > пере- > трет-, а окисление, наоборот, быстрее всего происходит при третичном атоме углерода.
Г л а в а 8
8.1. СОДЕРЖАНИЕ ЦИКЛОАЛКАНОВ В НЕФТЯХ
Циклоалканы (нафтены, цикланы) определяют особое место нефтей в ряду природных органических соединений; их массовое содержание в нефтях колеблется от 25 до 75%.
Циклоалканы присутствуют во всех фракциях. Их содержание обычно растет по мере утяжеления фракций, и только в наиболее высококипящих масляных фракциях оно падает за счет увеличения содержания ароматических структур. Особенно богаты циклоалканами бакинские и эмбенские нефти — 40— 60 %, а в отдельных фракциях до 60—80 % в расчете на нефть. В нефтях восточных районов России их значительно меньше.
Наиболее устойчивы пяти- и шестичленные циклы. Они и преобладают в нефтях — обнаружены многие гомологи цикло-пентана и циклогексана; высшие фракции нефти содержат также бициклические и трициклические углеводороды различного строения (СпНгп-г, С„Н2л-4). главным образом с двумя общими атомами углерода. Кроме того, в нефти найдены углеводороды, представляющие собой различные комбинации пяти-и шестичленных циклов, часто содержащие ароматические кольца,— так называемые гибридные углеводороды.
Содержание циклоалканов и их распределение по фракциям зависят от типа нефти (табл. 8.1).
Моноциклические циклоалканы с длинной боковой алкильной цепью термодинамически менее устойчивы, чем замещенные двумя или тремя более короткими радикалами. Поэтому существует предел усложнения моноциклических циклоалканов.
Распределение циклоалканов по типам структур определяется составом нефтей и температурными пределами перегонки фракции. Так, моноциклические циклоалканы исчезают
Таблица 8.1. Содержание циклоалканов в различных нефтях, %
По данным С. С. Наметкина
| Нефть |
Р2°, кг/м5 | Фракция, °С | |||||
| 60—95 | 95—122 | 122—150 | 150—200 |
200—250 | 250—300 | ||
| Сураханекая | 844,5 | 76 | 81 |
51 | 66 |
44 | 39 |
|
Балахаиская | 872,7 | 56 | 68 |
66 | 75 |
74 | 62 |
|
Балахаио-сабуичиио-ра- маиииская | 863,6 |
48 | 64 |
82 | 66 |
43 | 38 |
|
Бииагадинская | 918,0 | 48 | 55 |
56 | 70 |
65 | 58 |
|
Биби-эйбатская | 862,0 | 50 | 60 |
57 | 69 |
51 | 42 |
|
Грозненская парафинистая |
840,6 | 34 |
37 | 30 |
29 | 23 |
22 |
| Грозненская беспарафи-иистая | 858,0 | 35 | 40 |
33 | 39 |
40 | 37 |
|
Вознесенская | 897,0 | 11 | 30 |
49 | 71 |
61 | 48 |
|
Майкопская | 844,5 |
40 | 45 |
40 | 39 |
36 | 36 |
|
Калужская | 952,0 |
— | — | — | — | 90 |
85 |
|
Доссорская | 858,5 |
40 | 63 |
57 | 69 |
67 | 61 |
|
Чусовская | 938,0 |
31 | 27 |
18 | 15 |
19 | 17 |
|
Тоикава (Оклахома) |
817,6 | 35 |
42 | 38 |
41 | 34 |
30 |
| Девинпорт | 792,3 | 29 |
34 | 27 |
29 | 31 |
31 |
| Мексиа (Техас) | 841,4 |
22 | 26 |
19 | 21 |
19 | 28 |
|
Хептиигтон-Биг (Калифорния) |
984,8 | 40 |
56 | 55 |
61 | 45 |
41 |
| Самотлорская (смесь) | 843,0 |
38 | 32 |
30 | 24 |
31 | 28 |
|
Козубаевская | 852,0 | 21 | 21 |
20 | 12 |
19 | 9 |
|
Речицкая | 868,0 |
31 | 31 |
27 | 24 |
— | _ |
|
Ромашкинская | 862,0 | 18 | 23 |
27 | 25 | — | _ |
|
Комсомольская | — |
20 | 20 |
7 | 3 | — | _ |
|
Вятская | 886,0 |
22 | 20 |
22 | 17 |
33 | 30 |
|
Шараплийская | 844,0 | 25,5 | 23 |
14 | 12 |
и | 2 |
|
Караариииская | 961,0 | — | — |
— | — | 94 |
91 |
|
Узеньская | 845,0 |
37 | 35 |
23 | 20 |
12 | 8 |
|
Катанглийская | 940,0 | — | — |
— | 98* |
97 | 78 |
| Чубовская 883,0 * Фракции и. к. — 200 °С. ** Фрпкцня 85—180 °С. |
8** | ||||||
Рис. 8.1. Нафтеновые паспорта фракций 200— 430 °С нефтей различных месторождений (в расчете на нафтеновую часть):
а — Южио-Каспийской впадины; 6 — Западной Сибири; в — Волго-Урала
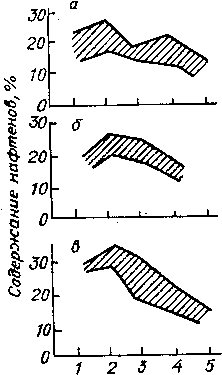
Число циклов -в молекуле
во фракциях 300—350 °С, бициклические § ^ одержатся во фракциях от 60 до 500 °С, |
причем количество их заметно убывает '|20-после 400°С. Трициклические находятся во фракциях выше 350—400 °С. Это распределение подвержено некоторым колебаниям, зависящим от типа ¦ нефтей. ^
Нафтеновые углеводороды составляют &30' значительную часть высококипящих о го-фракций любой нефти.
На индивидуальном уровне сложно идентифицировать огромное число структурных и пространственных изомеров нафтенов. Поэтому при их исследовании широко используют структурно-групповые методы.
Разработан масс-спектрометрический метод определения концентраций нафтенов, содержащих от 1 до 5 циклов в молекуле. Относительное концентрационное распределение нафтенов в зависимости от числа циклов в молекуле называется нафтеновым паспортом.
Заштрихованные на рис. 8.1 участки соответствуют областям изменения нафтеновых паспортов для нефтей соответствующих регионов. Характер иафтеиовых паспортов изученных нефтей разнообразен. Например, в нефтях Южного Каспия преобладают би- и тетрациклические нафтены в отличие от нефтей других регионов. Общей закономерностью нафтеновых паспортов является преобладание моно- и бицикланов над остальными нафтеновыми углеводородами. В среднем для большинства нефтей содержание моно- и бицикланов составляет 50—60% от суммы нафтенов (рис. 8.2), а доля пеитацикличе-ских структур не превышает 10%.
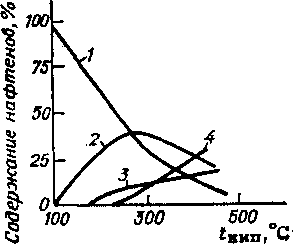
Основное различие нафтеновых паспортов нефтей проявляется в соотношении моно- и бицикланов. Есть нефти с при-
Рис. 8.2. Относительное распределение углеводородов по типу структур в иефти месторождения Грязевая Сопка:
1 — моноциклические; 2 — бициклические; 3 — трициклические; 4 — тетрациклические и более мерно одинаковым содержанием этих углеводородов, а также с преобладанием монодикланов над бидикланами. Напротив, в нефтях с низким содержанием н-алканов обычно бицикланы преобладают над моноцикланами. Как правило, концентрация цолициклических нафтенов снижается с увеличением числа циклов в молекуле.
Для генетически связанных нефтей относительное распределение нафтенов с различным числом циклов в молекуле не зависит от их суммарного содержания. Нафтеновые углеводороды по сравнению с алканами имеют более стабильный состав и сохраняют генетические признаки, обусловленные природой исходного нефтематеринского вещества и условиями его преобразования в нефтяные углеводороды.
Нафтеновый паспорт унаследован нефтью от исходного органического вещества и определяется литолого-фациальнымн условиями его преобразования. Наряду с соотношением при-стан/фитан нафтеновый паспорт можно с успехом использовать в качестве дополнительного критерия при установлении генетических связей нефтей. Ал. А. Петров систематизировал данные по относительному распределению насыщенных углеводородов (фракция 200—430 °С) в нефтях многопластовых месторождений и отметил единый характер изменения их углеводородного состава. Отмечено, что содержание нормальных н изопреноидных алканов, в отличие от содержания нафтенов, более чутко реагирует на изменение геохимических условий залегания нефтей,
С ростом молекулярной массы нафтенов повышается содержание в них полициклических молекул (см. рис. 8.2).
Согласно ранее опубликованным работам максимальное число циклов в нафтенах индивидуальных соединений равно пяти, однако имеются сведения, что оно может быть значительно большим — до восьми (см. с. 161).
Особенно важную роль в составе полициклических нафтенов имеют соединения изопреноидного типа.
Строение моноциклических нафтенов установлено надежно благодаря применению метода каталитического дегидрирования. Однако, начиная с цикланов С8, из-за присутствия ген-за^ мещенных углеводородов этот метод дает существенную ошибку и для исследования полициклических иафтенов применяется ограниченно. Наиболее существенные результаты дает в этом случае сочетание методов ГЖХ, встречного синтеза, хромато-масс-спектрометрии.
При установлении строения полициклической системы необходимо определить число циклов, число атомов углерода в циклической и алифатической части молекул, тип сочленения колец друг с другом, принадлежность углеводородов к определенному классу природных соединений.
Моноциклические циклоалканы, содержащие от пяти до восьми атомов углерода в молекуле, сосредоточены в основном но фракции н. к.— 125 °С. Для оценки их общего содержания в этой фракции исследовали нефти типичных месторождений (табл. 8.2). Выхдд фракции н. к.— 125°С составляет от 0,8 до 13,9 %, а содержание углеводородов ряда циклопентана в ней — от 14,5 (сургутская нефть) до 53 % (эхабинская нефть) и цик-логексанов — от 14 (сургутская нефть) до 36,5% {бакинская нефть, Грязевая Сопка).
Циклоалканы ряда циклопентана. Состав углеводородов ряда циклопентана приведен в табл. 8.3. Из нее видно, что содержание циклопентана в нефтях незначительно. Он обнаруживается максимально в количестве 3,0 % в расчете на сумму циклоалканов этого ряда. Содержание метилциклопентана возрастает до 24,5 % в сургутской нефти, в бакинских нефтях он практически отсутствует.
Основная масса соединений ряда циклопентана представлена углеводородами С7 и составляет 40—48,5 % в грозненской парафинистой, сургутской, паромайской и эхабинской. нефтях. Даже в бакинских нефтях, в которых обнаружены лишь следы циклопентана и метилциклопентана, содержание циклоалканов С7 достигает 28%- В составе углеводородов С7 преобладают наиболее устойчивые углеводороды—1,2- и 1,3-диметилцикло-пёнтаны, т. е. с метальной группой при разных углеродных атомах циклопентанового кольца. Содержание 1,1-диметилцикло-иентана и этилциклопентана заметно меньше, чем 1,2- и 1,3-циклопентанов.
Во фракции н. к.— 125 °С обнаружены в довольно значительном количестве циклопентаны Cg. Так, в грозненской пара-
Таблица 8.2. Групповой состав фракции н. к. —125 °С (С5—С8) в нефтях, %
| Нефть |
Фракция н. к. — 125 °С |
н-Алканы | Развет вленные алканы |
Углеводороды ряда циклопентана |
Углево дороды ряда цикло гексана | Арены |
| Грозненская парафинн-стая | 6,8 |
28,5 | 27,5 |
22,0 | 20,0 |
2,0 |
|
Сургутская | 5,7 |
41,5 | 30,0 |
14,5 | 14,0 |
— |
|
Паромайская | 13,9 |
14,5 | 16,0 |
31,0 | 31,0 |
7,5 |
|
Эхабннская Бакинская |
7,0 | 4,0 |
11,5 | 53,0 |
27,0 | 4,5 |
| Грязевая Сопка | 0,8 | 1,5 | 20,0 |
41,5 | 36,5 |
0,5 |
| Нефтяные Камни | 2,4 |
2,0 | 46,0 |
25,5 | 26,5 |
Следы |
| Примечание. Эта данным Ал. А. Петрова. |
таблица, | а также табл. 8.3—8.7, 8.10, | со СО 00 | 8.14™ по |
||
| Нефть | ||||||
|
Углеводороды | гроз |
бакинская | ||||
| ненская парафн- ннстая | сургут ская | паро майская |
эхабнн- ская | Грязе вая Сопка | Нефтя ные Камни | |
| 3,0 |
1,0 | 1,0 |
Следы | Следы |
| 24,5 | 17,0 | 8,0 | » |
2,0 |
| 40,0 | 47,0 | 40,0 |
12,0 | 28,0 |
| 29,0 | 14 |
10 | 17 |
9 |
| 8,5 |
5 | 12 |
33 | Следы |
| 30,0 | 40 |
53 | 36 |
35 |
| 32,5 |
41 | 25 |
14 | 56 |
|
32,5 | 35,0 |
51,0 | 88,0 |
70,0 |
| 20,0 |
16,5 | 23,5 |
23,0 | 12,5 |
| 4,5 | 2,5 |
1,5 | 8,0 |
8,0 |
| 19,0 |
22,0 | 20,0 |
25,0 | 23,0 |
| 17,0 | 37,0 |
35,0 | 16,0 |
31,5 |
| 39,5 |
21,0 | 20,0 |
28,0 | 25,0 |
* Сумма стереонзомеров.
финистой нефти они составляют 29,5, а в бакинскоя (Грязевая Сопка) даже 88 % от суммы циклоалканов фракции. Эти циклопентаны представлены в основном триметилциклопентанами и метилэтилциклопентаном, причем, как и в случае диметилцик-
Таблица 8.4. Состав углеводородов Сд ряда циклопентаиа в расчете на их сумму, %
| Нефть | ||||||
|
Углеводороды | бакинская | |||||
| грознен ская |
сургут ская | паро майская | *хабнн- ская | Грязевая Сопка |
Нефтяные Камин | |
|
1,2,3,4-Тетраметилцикло-пентаи * |
10 | 18,0 |
17,5 | 32,0 |
6,5 | 4,5 |
|
1,1,2,4-Тетрамегилцнкло-пентан * |
2,5 | 2,0 |
2,0 | 3,0 |
Следы | Следы |
| 1,4-Диметил-2-этил циклопентан * | 33,0 |
21,0 | 22,5 |
14,0 | 20,0 |
19,5 |
|
2,3-Диметил-3-этилцик-лопентаи * |
22,6 | 21,0 |
21,0 | 23,0 |
23,0 | 28,0 |
| 1,1 - Диметил-З'Этил циклопентан | 8,0 | 2,5 |
10,0 | 6,0 |
3,0 | 3,5 |
| Дизамещеиные цнклопеи- 24,0 таиы * Сумма стереоизомероа. |
35,6 | 27,0 |
22,0 | 41,5 |
44,5 | |
лопентанов, преобладают циклопентаны с заместителями у разных атомов углерода. Состав углеводородов С9 ряда циклопен-тана приведен в табл. 8.4, из которой видно, что среди них преобладают 1,2,3,4-тетраметилциклопентан, 1,4-диметил-2-этил-циклопентан и 1,2-диметил-З-этилциклопентан. Углеводороды с заместителем при одном атоме углерода, например 1,1,2,4-тетраметилциклопентан, присутствуют в небольших количествах— от долей процента до 3% на сумму циклоалканов Сд.
Несмотря на то, что рассмотренные нефти различны по содержанию легких компонентов и групповому составу (см. табл. 7.2), закономерности в распределении изомеров цнклоал-канов ряда циклопентана и циклогексана во всех нефтях достаточно близки. Имеются данные о распределении циклоалканов С7—С9 во многих нефтях различных месторождений, как отечественных, так и зарубежных. Во всех исследованных нефтях распределение циклических углеводородов примерно такое же, что и в приведенных выше примерах.
Циклоалканы ряда циклогексана. Состав циклоалканов ряда циклогексана приведен в табл. 8.5. Из нее видно, что массовое содержание циклогексана изменяется в широких пределах — от 1 % в бакинской нефти Грязевой Сопки до 18% в сургутской нефти — и значительно превышает содержание циклопентана. Содержание метилциклогексана, имеющего меньшую свободную энергию по сравнению с циклогексаном, превышает содержание циклогексана в 2—6 раз. Для ряда нефтей (эха-бинская, паромайская, сургутская, грозненская) метилциклогексан является основным компонентом (36,5—50 %). Во фракции н. к.— 125 °С обнаружены в довольно значительном количестве алкилциклогексаны Се. Меньше всего их содержится
Таблица 8.5. Состав углеводородов Се—С8 ряда циклогексана в расчете' на их сумму, %
|
Углеводороды | Нефть | |||||
| гроз ненская |
сургут ская | паро майская | эхабин- ская | баки Грязе вая Сопка | некая Нефтя ные Камни | |
|
Циклогекоан | 16,0 |
18,0 | 13,5 |
9,5 | 1,0 |
1,5 |
|
Метилциклогексан |
50,0 | 42,0 |
49,5 | 36,5 |
6,0 | 4,0 |
|
Замещенные циклогексаиы С8 | 35,0 | 40,0 |
37,0 | 54,0 |
93,0 | 94,5 |
| 1,2-диметшщиклогексаиы * |
19,0 | 15,0 |
22,0 | 26,0 |
27,6 | 44,0 |
| 1,3-диметил циклогексаиы * |
25,0 | — |
25,5 | 34,0 |
34,0 | 19,0 |
| 1,4-диметилциклогеюсаиы * |
15,0 | 41,0 |
16,5 | 17,0 |
17,0 | 24,5 |
| этилциклогексаи |
41,0 | 44,0 |
36,0 | 23,0 |
23,0 | 12,5 |
* Сумма стереоиаомеров. Небольшие количества 1,1-диметилциклогексаиа не учнты-Ш)ЛИСЬ.
| Нефть | |||||
|
Углеводороды | бакинская | ||||
|
гроз ненская | сургут ская | паро майская |
Нефтяные К амни | Кара- Даг» | |
ге.и-3амещенные циклогексана
1.1.2-триметилциклогексан
1.1.3-триметилциклогексан
1.1.4-триметилциклогекеан Тризамещеиные циклогексаны
1.2.3-триметилциклогексаны **
1.2.4-триметилциклогексаны **
1.3.5-триметилциклогексаны ** Дизамещенные циклогексаны
1-метил-З-этилциклогексаны ** 1-метил-4-этилциклогексаны **
* Газовый конденсат.
|
36 | 17 |
36 | 30 |
40 |
| 3 |
—г | 7 |
15 | 5 |
|
85 | - |
83 | 74 |
83 |
| 12 |
_ | 10 |
11 | 12 |
|
32 | 55 |
35 | 35 |
36 |
| 17 |
30 | 21 |
21 | 19 |
|
80 | 61 |
79 | 79 |
72 |
| 3 |
9 | Следы |
Следы | 9 |
| 32 | 28 |
29 | 34 |
24 |
| 61 |
68 | 58 |
58 | 51 |
|
39 | 32 |
42 | 42 |
49 |
** Сумма стереоизомеров.
в грозненской парафинистой нефти (35,%), в то время как в бакинских нефтях (Грязевая Сопка и Нефтяные Камни) эти соединения доминируют (93—94% в расчете на фракцию Са).
Среди замещенных циклогексанов Cg. помимо указанных в табл. 8.5 в очень незначительных количествах обнаружен 1,1-диметилциклогексан. Как и в случае диметилциклопентанов, преобладают циклогексаны с заместителями при разных атомах углерода. Соотношение этих изомеров колеблется не в очень широких пределах. Содержание этилциклогексана во фракции н. к.— 125°С разных нефтей сильно различается.
Состав углеводородов Cg ряда циклогексана приведен в табл. 8.6, из которой видно, что среди них находятся гем-, ди-и тризамещенные циклогексаны. Их содержание в нефтях различается незначительно, однако среди геж-замещенных цик'ло-гексанов преобладает термодинамически наиболее устойчивый
1,1,3-триметилциклогексан (74—83 % от суммы гем-замещенных), содержание 1,1,2- и 1,1,4-триметилциклогексанов существенно ниже (3—15%). Среди тризамещенных циклогексаиов преобладает 1,2,4-триметилциклогексан (61—80%), 1,3,5-три-метилциклогексан найден в виде следов в паромайской и бакинской (Грязевая Сопка) нефтях и достигает 9 % в сургутской и бакинской нефтях месторождения Кара-Даг. Среди дизаме-Щенных циклогексанов содержание 1-метил-З-этилциклогексана выше, чем 1-метил-4-этилциклогексана, в 1,5—2 раза. Это можно объяснить исходя из основного принципа конформацион-яого анализа — минимального отталкивающего взаимодействия
несвязанных атомов. В данном случае относительная термодинамическая устойчивость стереоизомеров определяется энергией взаимодействия атомов водорода в замещающих (метальных и этильных) радикалах, т. е. зависит от взаимного пространственного расположения радикалов. Такое взаимодействие характерно для цыс-изомеров и возрастает в ряду: диметил-, метил-алкил-, диалкилпроизводные. Среди эпимерных пар 1,2-диме-тилциклопентанов термодинамически более устойчив трамс-изо-мер. В случае 1,3-диметилциклопентанов в обоих изомерах (цис- и транс-) взаимодействие несвязанных между собой атомов углерода отсутствует, и поэтому термодинамическая устойчивость этих изомеров практически одинакова (табл. 8.7).
В случае 1,2,3-триметилциклопентаиа также термодинамически более устойчив транс,транс-изомер. Из четырех возможных стереоизомеров 1,2,4-триметилциклопентана термодинамически наиболее устойчив транс,транс-изомер, затем следуют цис,цис- и цис,транс-изомеры, а термодинамически неустойчивый транс,цис-изомер среди стереоизомеров 1,2,4-триметилциклопентана практически отсутствует.
В случае354 1,4-диметилциклогексана термодинамически более устойчив транс-изомер, имеющий экваториальную ориентацию обоих заместителей. Напротив, в цыс-изомере 1,3-диметилцикло-гексана цг*с-вицинальные взаимодействия отсутствуют, и более
Т а б л и ц а 8.7. Соотношение между стереоизомерами в циклоалканах некоторых нефтей
| Нефть | ||||||||
|
к | з | бакинская | ||||||
| Углеводороды |
грозненска | 8 «8 <0 2 а са я |
дагаджик- ская | <0 К (J Я ВВ \о са s | Грязевая Сопка | Нефтяные Камни | марковска; (Восточна? Сибнрь) | сургутская |
1.2-Днметилциклопен- 89:11 87:13 86:14 85:15 86:14 92 : 8 88: 1? 89:11
таны (транс/цис)
1.3-Диметилциклопеи- 57 :43 52:48 51:49 51: 49 53:47 60 :40 58 :42 56:44 таны (цис/транс)
1.2.3-Триметилцикло- 76:24 87:13 75:25 81 :19 81:19 84:16 89: 11 86:14
пентаны (транс,
транс/транс, цис)
1.2.4-Трнметилцикло- 89:11 86:14 86:14 74:26 80:20 86:14 50:10 88:12
пентаны {транс, транс/
цис, транс + цис, цис)
Диметнлцнклогекса- 90:10 88:12 86:14 90:10 83:17 88: 12 91; 9 85:15
ны (1,3-цис + 1,4-гранс)/(1,3-транс +
+ 1,4-цис) *
устойчив этот изомер с диэкваториальным расположением ме-тильных групп.
Из табл. 8.7 видно, что природа нефти не оказывает существенного влияния на соотношение стереоизомеров, определяемое главным образом факторами термодинамической устойчивости, однако аномально высокое содержание некоторых циклоалканов (метилциклогексан, этилциклогексан), превышающее равновесное, вероятно, тесно связано с происхождением нефти, генезисом исходного нефтематеринского вещества.
Во фракции Сд содержится реликтовый углеводород (1,1,3-триметилциклогексан) —продукт деструкции каротиноидов. Его следующий гомолог — 1,1,2,3-тетраметилциклогексан — обнаружен во фракции Сю. Состав цикланов Сю был расшифрован современными методами анализа. В нафтеновых нефтях во фракции Сю (150—175°С) было идентифицировано 87 углеводородов, главным образом производных циклогексана. В этой фракции определены некоторые бицикланы — бицикло [4.3.0] -нонан, производные бицикло [3.3.0]-, бицикло [3.2.1]-, бицикло-[2.2.2] октана.
Исследовали также нефти парафинового основания месторождений Грозненское, Самотлор, Мирзаани (соответственно тип А1, А1, А2 по классификации Ал. А. Петрова). Проведена полная идентификация их углеводородного состава и определены индексы Ковача структур, обнаруженных в нефтях и в модельных углеводородах с температурами кипения в указанных пределах. Нефтяные фракции выделяли ректификацией на колонке эффективностью 70 теоретических тарелок, а затем деароматизировали вытеснительной хроматографией иа силикагеле. Основными аналитическими методами были капиллярная ГЖХ и хромато-масс-спектрометрия. Хроматограмма фракции 150—175 °С нефтей месторождения Грозненское (рис. 8.3) по-
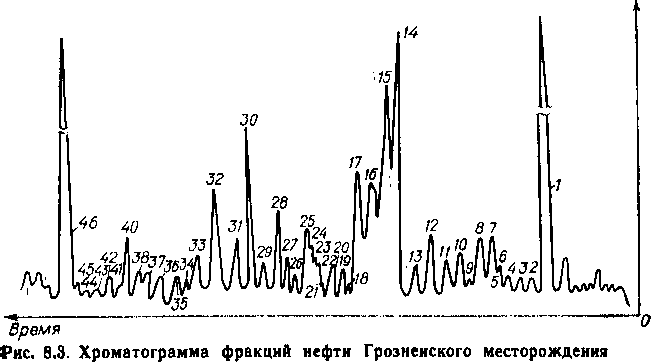
¦чучена на стальной капиллярной колонке 50 м X 0,25 мм с неподвижной фазой—скваланом при 80°С в токе Н2. Давление па входе в колонку 0,05 МПа. Идентификации углеводородов, их количественные соотношения в нефти и расшифровка хроматограмм приведены в табл. 8.8,
Качественно состав углеводородов нафтеновой части фракции аналогичен составу этих фракций нефтей нафтенового основания. Однако распределение углеводородов в смесях, образующих тот или иной пик на хроматограммах, а также и соотношение этих пиков по данным хромато-1масс-спектрометрии различное. Соотношение групп углеводородов в исследованных нефтях показано в табл. 8.9, где для удобства сопоставления с нефтями нафтенового основания (исключены н-алканы) распределение дано в расчете на нафтеноизоалкановую часть фракции. Характерным отличием исследованных нефтей является значительно меньшее содержание бициклических углеводородов и возрастание доли моноалкил- и метилалкилза-мещенных циклогексанов. Последнее более заметно, если исключить из рассмотрения изоалканы, которые в нефтях нафтенового основания составляют меньше 10% и превышают половину в рассматриваемых образцах. Как и в нафтеновых нефтях, содержание алкилциклопентанов очень невелико, а число изомеров может быть большим.
Для идентификации нефтяных углеводородов в исследуемой фракции 150—175 °С наряду с применением эталонных смесей и модельных углеводородов авторы рекомендуют использовать индексы Ковача.
Многообразие нефтяных углеводородов не исчерпывается структурами, приведенными в цитируемых работах. В интервале температур кипения м-ионана и м-декана (150—175°С) хроматографируется (в приведенных выше условиях) 105 углеводородов.
Во фракции 200—420 °С самотлорской нефти обнаружены методами хромато-масс-спектрометрии гомологические ряды н-алкилциклогексанов и м-алкилциклопентаиов С12—С25. Общее содержание последних составляет ~10% от суммы н-алканов той же фракции. В последнее время доказано наличие в нефтях гомологических серий метилалкилциклогексанов состава Сю—С25.
Циклогексаны каротинондной структуры. В нефти месторождения Каражанбас идентифицированы гомологи 1,1,3-триметил-2-алкилциклогексаиа состава Сю—С24:
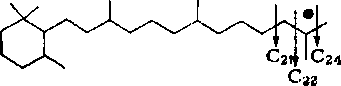
Таблица 8.8. Состав нефтяных фракций 150—175°С, %, и индексы Ковача углеводородон
Кг пика иа хроматограмме (рнс.
8.3)
|
Месторождение | ||||
| Углеводород | ||||
| Грознен ское | Самотлор |
Мнрзаанн | Ковача |
|
|
1 | транс-1 -Метил-4-этил циклогенез н |
3,0 | 5,0 |
— | 900,0 |
| и-Ноная |
14,5 | 24,6 |
11,6 | 900 | |
| 2 | транс, транс, транс-1,2,3-Триме-тил-4-этилциклопентан | 0,1 | 0,1 |
0,1 | 902,0 |
| 3 | транс, транс, транс- 1,2,4-Триме-.тил-3-этилциклопеитан |
0,2 | 0,4 |
0,1 | 904,5 |
| 4 | 3,3,5-Тр иметилгепта и | 0,3 |
— | 0,3 |
908,0 |
| 5 |
2,3,3,5-Теграметилгексан |
— | 0,2 |
— | 910,0 |
| транс-1 -Метил-З-этилцикло-гежеан | 0,2 | 911,5 | |||
| 6 |
транс-1 -Метил-2-этилцикло-гекоан |
0,2 | 0,5 |
0,3 | 913,5 |
| 7 | 2,4-Диметилокта н | 1,0 | 1.9 | 0,5 | 916,0 |
| 8 |
цис-1 -Метил-4-этилциклогек-сан |
0,7 | 0,2 |
0,3 | 917,5- |
| 9 |
эн<5о-3-Метилбицикло[3.3.0]- окган | 0,2 |
0,5 | 919,5 | |
| 10 |
экзо-2-Метилбицикло[3.3.0]- октаи | 1,3 |
2,0 | 0,2 |
920,6 |
| 11 |
2,5-Диметилоктан |
0,7 | 1,3 |
0,9 | 922,5 |
| 12 | Изоп ро пилциклогекса и | 1 Л | 1,3 |
1,3 | 926,0 |
| 13 |
экзо-3-Метилбицикло[3.3.0]- октан | 0,7 |
0,3 | 0,6 |
927,5- |
| 14 |
2,6-Днметилактан |
3,4 | 6,2 |
5,3 | 932,0 |
| 15 |
Пропилцнклогексая |
3,5 | 4,5 |
4,2 | 934,0 |
| 16 |
З-Метил-4-этилгептан |
0,3 | 0,8 |
2,2 | 934,0 |
| 17 | 2-Метил-З-этил гептан | 4,0 |
1,8 | 4,4 |
938,0 |
| 18 |
цис-1,1,2,5-Тетраметилцикло-гексан | 0,1 | 0,3 |
0,1 | 941,5 |
|
1,1,2,4-Тетраметилциклогексан |
0,1 | 0,2 |
0,1 | 941,5 | |
| цис, цис-1,3-Цнметил-4-щ>о-пилциклопента н | 0,2 |
0,3 | 0,2 |
942,5 | |
| 19 |
цис-1,1,3,4-Тетраметилцтсло-гексан | 0,2 | 0,2 |
0,1 | 944,0 |
| 20 | транс, транс, цис-1,2,3,5-Тег-раметилдиклогексан | 0,1 | - |
—_ | 945,0 |
| 21 |
экзо-1,3-Диметил бицикло-[3.3.0]-октаи | 0,3 | “ | 946,0 | |
| 1,1 - Диметил-З-этилциклогек- сан | 0,5 | 0,3 |
0,3 | 946,0 | |
|
экс?о-2-Метилбицикло(3.3.0]- октаи | 0,2 |
0,3 | 0,3 |
948,0 | |
| 22 |
1,3-Диметил-1 -этилциклогексан | 0,2 | 0,2 |
0,1 | 949,0 |
| 23 | цис, транс-1,3-Диметил-4-зтилциклогексан | - | 0,1 |
— | 950,0 |
| 42 |
гранс-3,4-Диметилоктан |
0,7 | 0,5 |
0,8 | 952,2 |
| № пика на хромато |
Углеводород |
Месторождение | ИнДекс |
||
| грамме (рис. 8.3) |
Грознен ское |
Самотлор | Мирзаани |
Ковача | |
| 25 |
цис-3,4-Диметилоктан |
0,7 | 0,4 |
0,8 | 954,0 |
| 2,3-Диметилоктаи |
• 1,9 | 0,5 |
2,0 | 954,0 | |
| цис, 1,3-Диметил-5-этил-циклогексан |
- | — |
0,4 | 954,0 | |
| 26 |
экзо-1,3-Диметилбицикло-[3.2.1]октаи | 0,1 | — |
о,1 | 957,0 |
| экзо-1,6-Д иметилбицикло-[3.2.1]октан |
0,1 | — |
- | 957,0 | |
|
27 | 5-Метилнонан |
1(2 | 1,4 |
1,3 | 958,7 |
| 28 | 4-Метил иона н | 4,4 | 4,3 |
5,2 | 960,0 |
| 29 | экзо, экзо-2,4-Диметилби-цикло[3.3.0]октаи |
- | 0,2 | 963,0 | |
| 30 | 2-Метилноиан |
6,0 | 4,5 |
6,8 | 964,0 |
| 31 |
1,5-Диметилбицикло[3.3.0]-октан |
0,3 | о.з |
— | 966,3 |
| экзо, экзо-2,8-Диметилби-цикло[3.3.0}октан | 0,5 | ‘- |
0,4 | 966,3 | |
|
транс-1,1,2,3-Тетраметилцик-логексаи | 1,3 | 0,3 |
0,5 | 968,0 | |
|
эндо-1,4-Диметилбицякло-[3.3.0]октан | 0,5 | 0,2 |
0,4 | 969,0 | |
| 32 | транс, транс-1,3-Диметил-5-этилциклогексаи | - | 0,2 |
0,5 | 969,0 |
| З-Метилнонан |
4,0 | 3,8 |
4,8 | 970,2 | |
| 33 • | экзо, эн<Зо-2,3-Диметил би-цикло^.3.0]октан | 0,1 |
973,0 | ||
|
экзо, эк<5о-2,6-Диметил бицикл о[3.3.0]октан | - |
0,2 | 973,0 | ||
| экзо, эндо-3,7-Диметилби-цикло[3.3.0]о«таи | - | 0,1 | 973,0 | ||
|
34 | транс, цис-1,2-Диметил-4-этилциклогексаи | 0,9 | 0,7 |
0,5 | 974,0 |
| экзо, экзо-2,7-Диметилби-цнкло[3.3.0]октаи |
0,3 | 0,2 |
0,6 | 975,0 | |
| 35 |
эндо-1,4-Диметилбицикло- [3.2.1]октаи | 0,2 |
0,2 | - |
975,0 |
| цис-1 -Метил-3- изопропил-цнклогексаи |
1,0 | 0,4 |
1,0 | 979,2 | |
| 36 | цис, транс-1,4-Диметил-2-этилциклогексаи | 0,9 | 1,5 |
1.1 | 982,5 |
| 37 |
гране-1-Метил-4-изопропил-циклогексан | 1,0 | 0,9 |
0,6 | 984,5- |
| 38 . | транс, транс-1,3-Диметил-2-этилциклогексан | - | - |
0,2 | 985,5 |
| 39 | Изо бутилцикл огексан | 0,3 | 0,9 | 0,5 |
985,5 |
|
чис-Бицикло-[4.3.0]нонан |
0,3 | 0,9 |
0,5 | 988,0 | |
| 40 |
Чис'1-Метил-З-пропилцикло- гексан | 1,0 |
0,4 | 1,4 |
989,0 |
Таблица 8.9. Распределение углеводородов фракции 150—175 °С по группам, %
| JMoXs пиков на хроматограмме | Группа углеводородов | Сумма углеводородов, месторождение | ||
| (рис. 8.3) | Грознен ское | Самот- лор |
Мирза* анн | |
| 12, 15, 35, 37, 40, 42, 43, 45, 46 |
Пропилзамещеиные цик-логевсаны |
23 | 23 | 21 |
| 38, 40 |
Бутилзамещенные цикло-гекеаиы |
1 | 2,0 | 1,0 |
| 1, 5, 6, 8, 11, 15, 21, 22, 25, 26, 27, 31, 33, 36, 38, 41, 44, 46 | Этилзамещениые цикло-гекеагаы | 13 |
18 | 9,0 |
| 1, 8, 11, 18, 19, 21, 23, 25, 28, 32 |
Гем-замещенные циклогексаиы |
3 | 1,5 | 1,5 |
| 18, 20, 23, 25, 28, 30-32, 37, 41, 42, 46 |
ТетраметЕлзамещенные циклогексаиы | - |
0,5 | |
| 2, 3, 13, 15—17, 26, 28, 30, 32, 41, 43 | Этилзамещениые циклогексаиы | 0,5 |
0,5 | 0,5 |
| 9, 10, 13, 18, 21, 23, 31—36, 38, 40, 42 | Метил- и диметилбицик-ло[3.2.0]октан | 7 | 7 | 7 |
|
4, 8, 14, 17, 21, 22, 24—26, 28, 31, 34—36, 38, 39, 45, 46 |
Метил- и диметилбицик-ло[3.2.1] и [2.2.2]октэны | 1,0 | 0,5 | 0,5 |
| 27, 39 |
Бицикло[4.3.0]нонан | 0,5 | 1.5 | 1,0 |
| 4, 6, 7, ,10, 13, 14, 16, 17, |
Изоалканы | 51 | 46 | 58 |
| 24, 25, 27, 28, 30, 32 | Моноциклические изоалканы | 0,9 | 1,2 | 0,7 |
|
Бициклические изоалканы | 0;2 | 0,15 | 0,1 |
|
Гомологов состава Ci2 и Сп не обнаружено. Строение первого из рассматриваемых гомологов подтверждено спектрами ЯМР 13С. Ориентация заместителей при С = 2 и 3 всегда транс-(е,е). Общее количество данных углеводородов в изучаемой фракции —3% (в пересчете на нефть ~1 %).
Отсутствие в смеси циклана Сп указывает на то, что эти углеводороды образуются не из алифатических изопреноидов нерегулярного типа строения. Наличие моноциклана С22 позволяет исключить из возможных предшественников и изопреноиды регулярной структуры. Таким образом, изучаемые мо-ноцикланы (гомологи 1,1,3-триметилалкилциклогексана) образуются из соединений каротиноидной структуры.
В бензиновых фракциях любой нефти содержится в значительных количествах 1,1,3-триметилциклогексан — продукт термодеструкции 1,1,3-тр иметил-2-алкилциклогексанов.
Кроме тетразамещенных моноцикланов в нефти Каражанбас идентифицирована серия углеводородов Си—Ci6 формулы (II).
Обнаружен также циклан с изопреноидной цепью состава С40 (HI), предположительно присутствующий в липидах древних бактерий:
(и)
Сга
JL_~
(m)
В нефтях обнаружен гидрированный димер фитадиена состава С40, образованный по .реакции Дильса — Альдера.
8.3. ПОЛИЦИКЛИЧЕСКИЕ ЦИКЛОАЛКАНЫ
Большое количество циклоалканов содержится во фракциях выше 400°С. Даже в парафинистых нефтях, таких-как сура-ханская и грозненская, во фракциях 400—550°С содержится 70—80 % циклоалканов.
Циклоалканы высших фракций нефти содержат одно или несколько колец с длинными боковыми алкильными цепями. Эти углеводороды, а также циклоалканы сложной конденсированной структуры представляют собой при обычной температуре твердые вещества.
В калифорнийской нефти найдены циклоалканы с числом углеродных атомов 7, 8 и 9; они имеют бициклическое строение с внутренними связями метиновых групп.
Бициклические нафтены бывают мостикового (IV), конденсированного (V) , сочлененного (VI) и изолированного (VII) типов строения:
(V)
Бициклические углеводороды — гидриндан и декалин — обнаружил в 30-х годах в нефтях И. Д. Зелинский. В катализа-тах дегидрирования нефтяных фракций он идентифицировал индан и нафталин. Ал. А. Петров из фракции 125—150°С нефти месторождения Грязевая Сопка (Баку) методом термодиффузии выделил концентрат бициклических углеводородов С8—С9 (табл. 8.10).
Таблица 8.10. Состав бнциклических циклоалканов С8—Сд,
идентифицированных в нефти месторождения Грязевая-Сопка, %
| Углеводород |
В расчете на нефть | В расчете иа сумму изомеров | |
| ( |
:8н14 | ||
| зкзо-2-Метилбицикло[2.2.1 ]гептан | 0,0001 . | 0,4 | |
|
э«до-2-Метилбицикло[2.2.11гептаи |
0,00002 | 0,1 | |
|
Бицикло[3.3.0]октан | 0,017 | 67,9 | |
|
Бицикло[3.2.1 ]октан |
0,008 | 31,6 | |
| СэН16 | |||
|
1 -Метилбицикло[3.3.0 | октан | 0,032 | 16,4 |
| 1 -Метил бицикло[3.2.1 |
октан | 0,027 | 13,8 |
| 1-Метилбнцикло[2.2.2 |
октан | 0,015 |
7,6 |
|
эядо-З-Метнлбицнкло |
3.3.0]октан | 0,018 |
9,2 |
|
экзо-2-Метилбицикло[3.3.0]октан |
0,052 | 26,6 | |
|
экзо-3-Метилбицикло[3.2.1]октан |
0,018 | 9,2 | |
|
э/сзо-3-Метилбицикло[3.3.0]октан |
0,007 | 3,6 | |
|
экзо-6-Метилбнцикло[3.2.1]октан |
0,005 | 2,5 | |
|
э«до-2-Метилбицикло[3.3.0]октан |
0,006 | 3,1 | |
|
эндо-2-Метилбицикло[3.2.1]октан |
0,005 | 2,5 | |
|
2-Метилбицикло[2.2.2]октан | 0,001 | 0,5 | |
|
эндо-6-Метилбицикло[3.2.1]октан |
0,002 | 1,0 | |
|
транс-Б ицикло[4.3.0]нонан |
0,007 | 3,5 | |
|
экзо-2-Метил биц икл о[3.2.1 ]окта н |
0,001 | 0,5 | |
| цис-Бицикло[4.3.0]нонан |
— | - | |
Ф. Д. Россини идентифицировал в нефтях транс-декалин и цис-пенталан — бицикло [3.3.0] октан. Линдеман и Турно из калифорнийской нефти методом термодиффузии выделили нор-борнан и его метильные гомологи, а также бицикло [3.3.0] октан,, бицикло [3.2.1] октан, бицикло [2.2.2] октан, транс- и цис-бицикло [4.3.0] нонаны.
В ряде нефтей обнаружены бицикланы (VIII—XIV) и иж метильные и диметильные гомологи:
(IX)
бицикло |3.3.0| октан—пеитала н
Ф
4
(VII[)
бицикло[2.2.1]гептан—норбораи
Э
71—2—16
(X)
бнцикло[8.2.1|октан
(XI)
бицикло12.2.2]октаи
84^ О
(XII)
бмвдкло[3.3.1]ионаа»
2 9
(XIII)
бицикло[4.3.0]ионан—гидриндаа
Концентрация углеводородов ряда норборнана в нефтях очень незначительна. Среди бицикланов С8—Сю в наибольших количествах содержатся углеводороды ряда бицикло [3.2.1] октана и особенно бицнкло [3.3.0] октана. Содержание бицикланов ряда пенталана — бицикло [3.3.0] октанов — составляет более 40 % от бицикланов С9—Сю.
8
9
,3
'4
7
5
(XIV)
бицикло [4.4.0] декан—дека лин
В нефтях наиболее распространены бициклические углеводороды, имеющие конденсированные кольца, затем идут углеводороды мостикового строения и сочлененные углеводороды. Из конденсированных бицикланов в нефтях встречается лишь цис-пенталан, так как молекула грамс-пенталана сильно напряжена. Для 2- (XV—XVI) и 3-моноалкилзамещенных бицикло-13.3.0] октанов возможно существование двух пространственных изомеров: эндо- и экзо-. В эндо-изомере заместитель направлен -В сторону второго кольца, в э/сзо-изомере— в обратном направлении
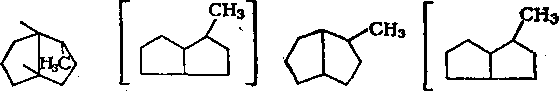
(XV)
эндо-2-метилбицшсло[3.3.0]октан
(XVI)
8кзо-2-метилбицикло[3.3.0]октан
(XVII)
(XVIII)
цис-
транс-
Как сам бицикло[4.3.0]нонан (XIII), так и его гомологи существуют в виде двух конформаций (цис- и транс-). Оба эти изомера найдены в нефти. В транс-изомере обе связи, образующие пятичленное кольцо, имеют экваториальную ориентацию, в цис-изомере (XVII) одна связь аксиальна.
Особенностью состава бицикланов Сю является присутствие больших количеств термодинамически весьма устойчивого транс-декалина (транс-изомер — 0,27% на нефть месторождения Грязевая Сопка, цис-изомера всего 0,02%). Углеводороды ряда декалина составляют в нефтях примерно половину всех бицикланов Сю, Сц, С|2. Из метильных гомологов декалина в этой же нефти идентифицированы цис-З-метил-гранс-бицикло-[4.4.0]- и транс-2-метил-гранс-бицикло[4.4.0] деканы (по 0,15 % на-нефть). Эти же углеводороды идентифицированы и в нефти Сургутского месторождения.
Бициклические углеводороды с конденсированной системой шестичленных циклов ряда бицикло [4.4.0] декана (декалина — XIV) принадлежат к числу важнейших нефтяных углеводородов. Ниже приведены пространственные изомеры декалина:
(XIX) цис-
(XX)
транс-
Рассмотрим конформации углеводородов с мостиковым типом сочленения колец.
В качестве примера приведем пространственное изображение структуры бицикло [2.2.1] гептана (норборнана):
Конформация бицикло[2.2.1]гептана (VIII) является жесткой и единственно возможной. Шестичленное кольцо в нем имеет форму неискаженной ванны.
Бицикло [3.2.1] октан (X) представляет собой устойчивую бй-циклическую систему, состоящую из пятичленного и шестичленного циклов:
Циклогексановое кольцо в этом соединении имеет конформацию кресла, несколько искаженную около атома углерода в мостике (С = 8). Циклопентановое кольцо имеет форму конверта, причем, в отличие от пя-гичленных колец в норборнане, здесь имеет место лишь весьма небольшое отклонение в связях
1—8 и 5—8 от байеровского валентного угла. Атомы углерода 1, 5, 6 и 7 лежат в одной плоскости. Связи, образующие циклопентановое кольцо (5—6, 1—7), ориентированы аксиально,
однако это не приводит к энергетически невыгодной структуре, ибо 1,3-диаксиальное взаимодействие несвязанных атомов в данном случае отсутствует.
Бицикло[2.2.2] октан (XI) представляет собой симметричную систему двух сочлененных между собой в положении 1—4 цик-логексановых колец. Конформация углеводорода «ванна — ванна»:
Структура свободна от «байеровского» напряжения, но имеет значительное «питцеровское» напряжение.
Бицикло [3.3.1]ноиан (XII) построен путем 1,3-сочленения циклогексановых колец. Он находится в симметричной конформации «кресло — кресло» несмотря на то, что существует сильное трансаннулярное взаимодействие аксиальных атомов водорода уС = ЗиС = 7. |
Сесквитерпановые углеводороды Си — Ci6 — по-лиметилзамещеиные декалины — найдены в нефтях Анастасиев-ско-Троицкого, Сивинского, Лома-Новиа и ряда других место* рождений. Это углеводороды реликтового характера (Х|Х1— XX|VII). Сочленение колец везде транс-. Ориентация метальных и этильных заместителей при С = 2 и С = 3 всегда экваториальная:
(XXII)
(XX
(XXVI) (XXVII)
Структура (XXV) найдена в нефти Лома-Новиа, а структуры Х|ХП и XXIV (транс-2,3,3,7,7, и цис-2,2,3,7,7— пентаметил-бицикло [4.4.0] деканы) идентифицированы в анастасиевско-троицкой нефти.
Докембрийская нефть Сивинского месторождения содержит лабор большого числа близких по строению углеводородов.
Трициклические нафтены в зависимости от расположения колец бывают трех типов — мостикового типа, с конденсированной системой колец и смешанные.
К числу чисто мостиковых углеводородов относится трицик-ло[3.3.1.13,7]декан— адамантан (XXVIII).
Кроме адамантана в нефтях содержатся его моно-, ди-, три-метильные и -этильные гомологи состава Сц — С15. При гидрокрекинге адамантан и его гомологи не преперпевают деструкции, что позволяет надежно анализировать их в соответствующих фракциях (200—250°С).
Адамантан, обладающий весьма своеобразным полиэдрическим строением, впервые был выделен из годонинской нефти (Чехословакия); его исследовали в 1933 г. Это кристаллическое вещество, которое плавится при 269°С (самая высокая температура плавления среди всех известных углеводородов). Молекула адамантана состоит из трех конденсированных циклогек-сановых колец, имеющих форму кресла. Пространственное положение атомов углерода в молекуле адамантана такое же, как и в кристаллической решетке алмаза.
Производные адамантана (табл. 8.11) находят широкое применение в различных областях (лекарственные вещества, полимеры и др.)- Содержание адамантана н отечественных нефтях |(в том числе и в нафтеновых—Балаханское и Сураханское месторождения) невелико: 0,004—0,01 %. В балаханской тяжелой нефти (Баку) во фракции 200—225 °С идентифицировано 24 ал-
Таблица 8.11. Состав углеводородов ряда адамантана,
идентифицированных в нефти месторождения Грязевая Сопка, %
|
Углеводород | В расчете на иефть | В расчете на сумму углеводородов |
| Адама нтан | 0,027 |
9,5 |
| 1 -Метила дамантан | 0,091 |
32,0 |
| 2-Мет иладамантан | 0,049 |
17,0 |
| 1,3-Диметил ад амантан | 0,076 |
26,5 |
|
1,3,5-Триметиладамантан |
0,043 | 15,0 |
киладамантана состава Сц — Си, содержащих метильные и этильные заместители. Общее содержание алкиладамантанов составило 0,02%, что в 20 раз превышает содержание в этой нефти самого адамантана.
К настоящему времени в нефтях установлено присутствие моно-, ди-, три- и тетразамещенных алкиладамантанов, содержащих метильные и этильные заместители в различных положениях ядра адамантана. Наряду с наиболее устойчивыми алкиладамантанами, содержащими заместители у третичных узловых атомов углерода ядра адамантана (положения 1, 3, 5 и 7), в нефти обнаружены, и притом в значительных количествах, алкиладамантаны с заместителями у вторичных атомов углерода (положения 2, 4, 6). Следовательно, соотношение изомеров алкиладамантанов в . нефтях не соответствует равновесному.
Соединения, содержащие адамантановое ядро, среди веществ' растительного и животного происхождения не обнаружены. Предположительно углеводороды ряда адамантана образовались в результате вторичных процессов, например в результате изомеризации других трициклических углеводородов, присутствующих в нефти. Последнее подтверждается хорошим соответствием относительно содержания алкиладамантанов в нефти их содержанию в неравновесных смесях, полученных при каталитической изомеризации трициклоалканов.
Значительные трудности встречаются с идентификацией би-циклоалканов Сю и выше.
В бакинской нефти месторождения Грязевая Сопка Ал. А. Петровым определено количественное соотношение между диметил-бицикло [3.2.1] октанами и диметилбицикло [3.3.0] октанами. Идентифицировано 12 соединений с различным положением метильных заместителей. Ниже приведены сводные данные об относительном содержании в нефти месторождения Грязевая Сопка (фракция 125—230°С) бициклических и трициклических
углеводородов, а в них — соотношение декалинов и «недекали-новых» углеводородов (по данным Ал. А. Петрова):
с»
![]()
57:43 43:57 49:51
Бициклоалканы/трицик- 100,0:0 лоалканы
Декалииы/другие бицик- — лоалкаиы
По мере увеличения молекулярной массы фракции возрастает и содержание в ней би- и трициклических углеводородов. Общее массовое содержание би- и трициклоалканов, перегоняющихся в пределах 125—230°С, составляет 2,10% в расчете на всю нефть месторождения Грязевая Сопка, или 28,5 % исследованной фракции. Суммарное соотношение между бицикло-алканами и трициклоалканами равно 87: 13.
Неадамантановые трицикланы Си — Сн составляют 80— 90 % всей суммы трицикланов. Термодинамически устойчивыми являются 1-метил-; 1,3-диметил-; 1,3,5-триметиладаманганы (см. табл. 7.11).
Нефтяные трицикланы Сц — С12 являются в основном протадамантановыми углеводородами (предшественниками адамантана). Эти углеводороды обнаружены в нефти. В модельных реакциях их легко получают изомеризацией би- и трицикланов (см. схему 8.1).
В изомеризатах преобладают соединения (XXXV), (XXXVI) и (XXXIX;). В дальнейшем псевдоравновесная смесь (XXXIV) — (XXXI Х|) медленно превращается в 1- и 2-этилада-мантаны.
Наряду с соединениями (XXXI) — (XXXIX) в нефтях содержится ряд адамантаноидных тетрациклических углеводородов. Из трицикланов С12 в значительных концентрациях в нефтях содержатся метилпроизводные трициклоундеканов типа (XXXI) и (XXXIII).
При анализе углеводородов нефти широко используют сочетание различных методов анализа. Так, сочетанием газовой хроматографии и хрома то-ма сс - спетрометри и изучен состав полициклических реликтовых углеводородов в нефтях палеозойских отложений Татарстана.
Нефти Татарстана имеют однотипный характер распределения стеранов С27 — С2э и гопанов С27 — С33 независимо от геологического возраста нефтей, глубины их залегания и физикохимических свойств. В этих нефтях мала концентрация сгера-нов, они являются нефтями гопонового типа.
Методами термодиффузии, комплексообразо-вания с тиокарбамидом, газожидкостной хроматографии и хромато-масс-спектрометрии ис-
(XXXI) трицадпо( 5.3.1.03,7)ундеван
(XXXII)
-{Ю-+-С?0
(XXIX)
(XXX)
трицикло(5.Э.1.0 ,7) ундекан
(ХХХШ)
трииикяо f6.3.0.0 ) ундекан
(XXXIV) экЭо-трициклоСб.ЗЛ.О1’6) додекан
(XXXV)
э«0о-трицикло (7.2.1.0 ’ ) додекан Ю
эмдо-трицикло (5.Э.1.1 ’ )додекан (XXXVII) акти-трицикло (5.3.2.01'6) додекан
11 \з (XXXVI)
4
a.iu
ею
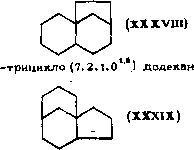
эм0о-трицикло (6.Э.1.01’5) додекан
Схема 8.1. Изомеризация би- и трицикланов
следованы трициклические углеводороды фракции 180—250 °С нафталанской нефти.
Идентифицировано 15 углеводородов трицикло^.З.О.О1'6] -(XX|XIII) и 1-метилтрицикло[5.3.1.0®'8]ундекан (XL, эндо-три-цикло [7.2.1.01*®] -(XXiXV), трицикло [6.3.1.01*6] - (XLI), э/езо-три-
цикло[7.2.1.01’6] (XXXV) и трицикло[5.3.1.14’!1]додеканы(ХЫ1)> тетрацикло (6.3.1.16’10.02'6)тридекан(ХЫ И, адамантан(ХХуШ),
1-метил-, 2-метил-, транс-1,4-диметил-, 1,2-диметил-, 1-этил-,.
2-этил-, транс-1 -этил-4-метиладамантан.
(XU)
Н3С
(XL)

(XLII)
(XL1I1)
Углеводороды со структурой пергидрофе-нантрена (Cig— С2б) были найдены в значительных количествах в нефти Сивинского месторождения. Полиметилалкнлпер-гидрофенантрены, как и полиметилдекалины, присутствуют во многих нефтях. Во фракции 300—420 °С сивинской нефти методом хромато-масс-спектрометрии идентифицирована серия три-циклических углеводородов Cig — С26 (XL1V — L) со скелетом полностью гидрированного фенантрена:
(XLIV)
(XLV)
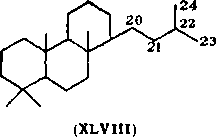
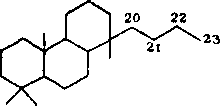
Сочленение циклов А/В и В/С в приведенных выше углеводородах— транс-, как и у важнейших терпеноидов. Предполагается, что одним из путей образования би-, три-, тетра- и пен-тацикланов изопреноидного типа строения является стадийная циклизация сквалена или близкого по строению изопреноида (Ал. А. Петров).
Тетрациклические нафтены мостикового типа (адамантаноидные) Cis — Сн. В различных нефтях кроме соединения (XLIII) определены тетрациклические углеводороды адамантоидного типа (LI) с чрезвычайно высокой степенью упаковки углеродных атомов.
тетрацякло[б.3.].02'6.05>10]додекан
метильные гомологи соединеиия(Ы)
Эти углеводороды в нефтях, по-видимому, образовались вследствие реакций изомеризации тетрациклических неадаман-таноидных углеводородов. Предполагается, что в нефтях могут содержаться каурены и гиббереллины 355.
В нефтях были определены насыщенные тетрациклические углеводороды со структурой пергидрохризена:
Сочленение колец в них транс-.
В нефтях и конденсатах Туркменистана во фракции 300— 550 °С обнаружена новая группа насыщенных тетр ациклических
углеводородов С19Н32, по строению являющихся дитерпенои-дами. Строение этих углеводородов доказано методами ЯМР 'Н и 13С и хромато-масс-спекгрометрией. Показано, что основными углеводородами данной серии являются 4,8-диметил-13-изопро-пилтетрацикло[6.6.0.01’11.03’7]- и 5,14-диметил-13-изопропилтетра-цикло [6.4.1.11>9.04>13] тетрадеканы:
Спектр ЯМР 13С приведенного выше углеводорода весьма характерен. Он содержит четыре метильные группы, из них две принадлежат изопропильному радикалу, один метил — ангу-лярный.
На тетрациклическую систему приходится 14 углеродных атомов. Химические сдвиги ядер 13С изопропильной группы показывают, что она не имеет вицинальных стерических взаимодействий, а лцнии одного из двух четвертичных атомов углерода сдвинуты очень сильно в слабое поле — 67,2 м. д. Такое значение химического сдвига может характеризовать только производные трицикло [6.3.0.0] ундекана, имеющие дополнительные ^-заместители у четвертичного атома углерода.
Кроме тетрациклододекана в нефти обнаружен пентацикло-тетрадекан (конгрессан). В нефти (и других каустобиолитах) был обнаружен ряд аналогов циклических политерпенов* а именно дитерпены С20 и тритерпены С30. Среди пентацикличе-ских тритерпенов были следующие:
Из нигерийской, ливийской и иранской нефтей выделена группа тетра- и пснтациклических углеводородов С27 — С3о.
В нефти найдены и другие тетрациклические структуры Cie — Q3, У которых в основе тетр ациклического ядра лежит
| Углеводород * |
Число атомов углерода |
Стереохимическая индикация (ориентация атомов водорода) |
|
|3,а-Днахолестан I | 27 |
10а, 136, 17а, 20S |
|
Р,а-Диахолестан II | 27 |
10а, 13(5, 17а, 20S |
|
24-Метил-{3,а-диахолестан I | 28 | 10а, 138, 17а, 20S |
|
24-Метил-|3,а-диахолестан II |
28 | 10а, 13р, 17а, 20R |
| 24-Этил-|3,а-диахолестаи I |
29 | 10а, 13р, 17а, 20S |
| 24-Этнл-|3,а-диахолесган II |
29 | Юа, 13(5, 17а, 20Ц |
| Изохолестан I | 27 |
5а, 14|3, 17Э, 20R |
|
Изохолестан II | 27 |
5а, 14Э, 17Э, 20S |
|
а-Холеетан | 27 | 5а, 14а, 17а, 20R |
|
24-Метилизохолестан I | 28 |
5а, 14(3, 17Р, 20R |
|
24-Метшшзохолестан II | 28 |
5а, 14(3, 17|3, 20S |
|
24-Метал-а-холестан (а-эргостан) |
28 | 5а, 14а, 17а, 20R |
| 24-Этилнзохолеетан I | 29 | 5а, 14(3, 17р, 20R |
|
24-Этнлизохолестан II | 29 |
5а, 140, 170, 20S |
|
24-Этил-а-холестан (а-ситостан) |
29 | 5а, 14а, 17а, 20R', |
| Трисноргопан I | 27 |
18^, 21р |
|
Трисноргопан II | 27 |
17а, 21Р |
| Бисноргопан | 28 | 17а, 18а, 21$ |
| Норгопан (адиантан) |
29 | 17а, 210 |
|
Гопан | 30 | 17а, 21(3 |
| Моретан | 30 | 17а, 21а |
|
Гомологи гопана: | ||
| X = С2Н5 (гомогопан) I | 31 | 17а, 21 р, 22S |
| X = С2Н5 (гомогопан) II | 31 | 17а, 21 р, 22S |
| X = С3Н7 (бисгомогопан) I |
32 | 17а, 21 р, 22R |
|
X = С3Н7 (бисгомогопан) II | 32 | 17а, 21 р, 22R |
| X *= С«Н» (трнсгомогопан) I | 33 |
17а, 210, 22S |
| X = С4Н9 (трнсгомогопан) II | 33 |
17а, 21 р, 22R |
| X = С5Нц (тетракисгомогопан) I | 34 |
17а, 21 р, 22S. |
| X - С5Н11 (тетракисгомогопан) II | 34 |
17а, 210, 22R |
| X = CeHi3 (пентакисгомогопан) I | 35 |
17а, 21 р, 22S |
| X = С6Н|з (пентакисгомогопан) II |
35 | 17а, 21 р, 22R |
|
* I, II—равновесные эпнмеры. |
система циклопентанопергидрофенантрена. Эти соединения принадлежат к стеранам.
Стераны и гопаны нефтей — важнейшие реликтовые углеводороды нефтей. В отличие от природных биологических, соединений, стераны нефтей стереохимически и структурно преобразованы. Стераны в условиях диа- и катагенеза в земной коре претерпевают сложное постепенное изменение конфигурации нескольких хиральных центров, что является важным при прогнозировании наличия залежей нефти в определенном регионе.
Исследование полициклических насыщенных углеводородов С27 и выше, имеющих углеродный скелет стероидов и тритерпе-
иоидов, несет важную информацию благодаря связи этих продуктов с биологическими предшественниками (хемофоссилии). Тетрациклоалканы состава С27 — С30 принадлежат к стеранам, а пентацикло алканы, содержащие от 27 до 35 атомов углерода,—к тритерпанам ряда гопана (табл. 8.12).
Структурные формулы нефтяных тритерпанов (LII), стера-люв (LIII), перегруппированных стеранов (LIV):
(LII)
Х=Н; СНз^СгН]—СаНц биологический: гопан: I70H. 2I3H нефтяной гопай: 17аН, 21(Ш моретан: 17(Ш, 21аН
(LIII)
Х=Н (холестаи)
Х=СН3 (24-метилхолестаи) Х=СгН5 (24-этилхолестаи)
(LIV)
X—Н (P.os-диахолестаны)
Х-СНз (24-метил-Р,а-диахолестаны) Х=С2Н5 (24-этил-Р.а-диахолестаны)
Согласно номенклатуре сплошной линией обозначены связи <3—Н, расположенные над плоскостью молекулы, а располо-жененые ниже — штриховой, волнистыми линиями — связи С—Н тех хиральных центров, где реально возможна эпимеризация, Происхождение стеранов (гидрированных стеринов) связывают со стероидами. Стероиды различаются характером заместителей (они могут содержать гидроксильную, кетонную и другие группы) и строением тетрациклического ядра. Гидрированные стерины могли образоваться из стероидов в результате ряда химических превращений, среди которых существенную роль должно было играть восстановление. Именно биологическое происхождение этих стеринов позволило рассматривать их как биологические «метки», а результаты исследования стери-нов связать с общими вопросами происхождения нефти.
Стерины и тритерпены построены из конденсированных алициклических колец, поэтому для них возможна стереоизомерия, зависящая от цис- или транс-расположения колец относительно* друг друга.
Стерины, как и стероиды, оптически активны, так как атомы углерода в местах соединений колец расположены асимметрично. Последнее должно было бы приводить к большому числу стереоизомеров. Так, например, у прегнана (стерин C2i) могло> бы существовать 128 стереоизомеров. При введении в ядро-заместителей и появлении двух дополнительных центров асимметрии число возможных стереоизомеров достигало бы 512. В действительности среди природных стероидов найдены четыре пространственные формы скелета, отвечающие энергетически наиболее выгодной конфигурации. Это относится и к стеринам. По-видимому, оптическая активность нефти в значительной мере обусловлена присутствием в ней углеводородов типа сте-ринов и тритерпенов. В настоящее время трудно дать оценку количественного содержания стеринов и терпенов в нефти.
Количественное распределение циклоалканов по числу циклов приведено в табл. 8.13.
В высших фракциях нефти могут присутствовать моноциклические полиметиленовые углеводороды с 28 атомами углерода в цепи (в нескольких цепях). При близких молекулярных массах и одинаковой температуре перегонки тяжелые нефти характеризуются содержанием циклоалканов с большим числом циклов, чем легкие. Исследованиями Ф. Д. Россини в нефти Понка-Сити найдены сложные циклоалканы с боковыми алкановыми цепями. Преобладали углеводороды с двумя и тремя циклами (15,7 и 11,2% в расчете на массу масляного' сырья). В экстрактах найдены различные гибридные углеводороды с числом циклов 2—5, из которых часть принадлежала
Таблица 8.13. Распределение циклоалканов с разным числом циклов во фракции 350—420 °С некоторых нефтей, %
|
Нефть |
Циклоалканы | |||
|
моноцик лические |
бицнкли- ческие |
трицикли- ческие |
тетрацнк- лические | |
| Бакинская (Нефтяные Камни) | 32,0 | 29,0 |
17,0 | 21,0 |
| Эмбииская (Кос-Чагыл) |
42,0 | 21,0 |
13,0 | 5,0 |
| Ромашкинская |
46,0 | 17,0 |
9,0 | 3,0 |
|
Грозненская парафинистая |
30,0 | 21,0 |
11,0 | 10,Q |
| Сургутская | 42,0 | 18,0 | 10,0 |
1,0 |
|
Нафталанская | 5,0 | 38,0 | 34,0 |
23,0 |
|
Поика-Сити (США) | 40,0 | 26,0 | 17,0 |
17,0 |
к циклоалканам и часть — к сложному ароматическому ряду с различным числом радикалов. Данные о гибридных циклоал-каноаренах приведены в гл. 9.
Как отмечено выше, высшие фракции нефти содержат в основном би- и трициклические углеводороды, замещенные одной или несколькими короткими цепями. Такая структура высших циклоалканов выводится из данных структурно-группового анализа, проведенного методом ИК-спектроскопии (табл. 8.14).
Строение циклоалканов первой группы (с шестичленными гкольцами) может быть отражено следующими формулами:
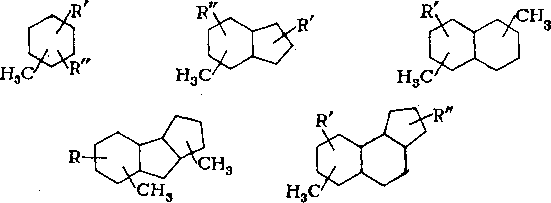
Соединения первых трех видов преобладают.
Для пятичленных циклоалканов (вторая группа), приведен-гных ниже, характерно наличие конденсированных колец:
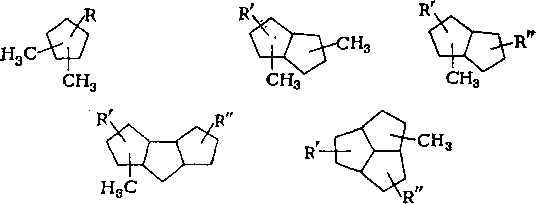
Здесь также наблюдается преобладание структур первых трех типов.
Значительно менее ясно строение мостиковых высокомолекулярных циклоалканов (третья группа). Это производные би-цикло [3.2.1] октана, бицикло [2.2.2]октана, адамантана:
СНз СНз
CM CN -и"
LC CM CO
-Г cT
Таблица 8.14. Число структурных элементов в расчете на среднюю молекулу циклоалканов с температурой перегонки 350—420 °С нефти месторождения Нефтяные Камни
1Л
со"
О Ю Tf
—Г —Г ©*
00
co~
00
CM
-И СО Ю
CO
eo
CM
CM.
ео
*
К
3
а
•в*
<D
CM — o*
CD
CD
r-
ci
см
со"
— О 1Л* ~н**
CD
-Н СО 1Л СМ*
00
ci
CO
CM
CO
00
CM CM о
со ci —Г
ст>
см
— СМ
1Л см
1»
*0*
s
о
S
CO
CM
00 1Л CO
CO CM -
co^
o>
Tf
00
О 1Л ^ СМ
ci
CD
^ СМ**
00 ^ ^
со” ci —Г
увеличением вокера фракции возрастает температура хонда ее кнления.
CM
см
CM
CM
о
e>
o'
CM ю
TP* ci —*’
С* 1Л
eo
CM
CM
CO*
00 О 00
ci ci o'
g к 5
2 « о
3«* s "
00 N —
тР frj CM
CO
2
>>
JL
«
к
о
04
5
8
5
4>
3
I
ь
I
w
!
/ \
S5L
я к
И
It
&
xo
о
CO CO 1Я 00
—¦ о
^ ct>
CM
ci о
CD tJ*
О t>
©“ ci
CO CO
nT in
00 О t> Ю
1Л
Tt*"
CO*
Достигнутые успехи в области исследования состава и ¦ строения циклоалканов еще не означают, что химический состав нефти полностью изучен. Особенно трудной областью по-прежнему остается химия циклоалканов, как весьма сложного и многокомпонентного класса нефтяных углеводородов.
Из приведенных данных следует, что циклоалканы и цикло-алкано-ареновые компоненты составляют главную массу углеводородов высококипящих фракций нефти.
3.4. НАФТЕНОВЫЕ УГЛЕВОДОРОДЫ ВЫСОКОКИПЯЩИХ ФРАКЦИИ
Для исследования была взята смесь западносибирских нефтей. По составу она близка к самотлорской нефти и содержит, %:
1,25
0,15
1,24
11,5
6,6
S
N
Асфальтены
Смолистые вещества
Парафины
При перегонке нефти была получена фракция 350—540°С. Массовый выход этой фракции на нефть составил 30,4 %.
•Фракция 350—540 °С имела плотность р4° 0,9164 при средней молекулярной массе 391, содержание в ней серы составило 2,2 и азота — 0,17%.
При изучении углеводородов фракции 350—540 °С основное внимание было уделено наименее изученной части нефтей — нафтенам.
Порядок исследования фракции нефти показан на схеме 8.2. •Фракция была разделена с помощью жидкостной хроматографии (силикагель АСК) на алкано-нафтеновые углеводороды (39,9%), ароматические углеводороды (53,5%) и смолистую часть (6,6%). Элюентами служили соответственно н-гексан, бензол и смесь бензол — спирт. Из алкано-нафтеновых углеводородов методом комплексообразования с карбамидом были выделены н-алканы. Однако они содержали значительное количество других углеводородов. Поэтому для выделения м-алка-нов полученный концентрат был подвергнут разделению на молекулярных ситах (цеолит, кальциевая форма, размер пор
0,5 нм). При этом из него было выделено 63 % н-алканов (4,3% на фракцию 350—540°С), 37% концентрата представляли собой смесь алканов разветвленного строения и цикланов, содержащих длинные алкановые цепи нормального строения.
Анализ выделенных н-алканов проводили методом газожидкостной хроматографии.
Жидкостная хроматография на силикагеле АСК
I
I
н-Алканы, изоалканы, нафтены (39,9 %)
Ароматические углеводороды .(53,5%)
Смолистая часть (6,6 %)
Комплексообразо-ваине с карбамидом?
Спектральный анализ
I
Углеводороды, образующие аддукт (6,9 %)
Углеводороды, не образующие аддукта, изоалканы, нафтены (33%)
Обработка
молекулярными
ситами
Дегидрирование
Ароматические углеводороды, изоалканы, нафтены (недегидрирующнеся)
I J
н-Алканы (4,3 °/о) Изоалканы
нафтены (26 %)
Жидкостная хроматография на силикагеле АСК
Анализ ГЖХ
I
4
Ароматические углеводороды, полученные дегидрированием нафтенов (17,7 %)
I
¦V
Изоалканы, нафтены (недегидри-рующиеся (15,3 %)
Спектральный анализ Схема 8.2. Исследование вакуумного газойля (350—-540 °С)
Использовали хроматограф «Цвет-2» с пламенно-нонизацнонным детектором, колонка 15 м X 0,25 мм, неподвижная фаза — апиезон L, газ-носн-теяь—Н2. Опыты проводили при программировании температуры от 130 до 315°С со скоростью 2°С/мин. Результаты анализа показали, что «-алканы имеют состав Cie—С«о. Общее содержание «-алканов Qe—С20 и Csi—С« составило соответственно 6,4 и 19,7 % от суммы н-алканов. Основная часть алканов приходится на алканы C2i—Сз0, суммарное содержание которых составило 73,9 %.
Ароматические углеводороды фракции 350—540°С изучены с помощью масс-спектрометрин.
Использовали масс-спектр MX 1320 при энергии иоиизнрующнх электронов 70 эВ и температуре источника ионов 250 °С. Образцы вводили в ионный источник из системы прямого ввода при 160 “С.
Таблица 8.15. Химический состав ароматических углеводородов фракции 350—450 °С и ароматических углеводородов, полученных дегидрированием нафтеновых углеводородов этой фракции
| Число | колец | Молярное содержание углеводородов, % | ||
| Общая формула | бензольных |
полиметиле-новых * | в исходной фракции | полученных дегидриро ванием нафтенов |
| СлНгп—б |
1 | 0 |
21,7 | 38,2 |
| 'СпНгл—8 | 1 | 17,9 | 21,3 |
|
| СпНгл-ю |
2 | 18,2 |
5,7 | |
| СлНгл—12 | 2 | 0 1 2 | 8,7 8,5 4,3 | 7,2 2.7 3.7 |
|
СлНгл—is | 3 |
0 | 6,4 |
4,4 |
| СпНгп-20 |
1 | 7,6 |
6,0 | |
|
СлНгя—22 | 4 |
0 | 4,4 |
6,5 |
| СпНгл-24 | 0 1 |
2,3 | 4,3 | |
| * Гексаметнленовые и пентаметиленовые кольца, конденсированные | с бензольными. | |||
Ароматические углеводороды исходной фракции 350—540°С (39,9%) содержали углеводороды с одним, двумя, тремя и четырьмя бензольными кольцами (табл. .8.15), причем преобладали углеводороды с одним бензольным кольцом (около 60 %). Углеводороды с двумя кольцами — замещенные нафталины.
Среди полициклических углеводородов возможно присутствие замещенных фенантрена, пирена, хризена и др.
Данные о строении алкильных групп ароматических углеводородов были получены с применением метода ЯМР 13С.
Спектры регистрировали на спектрометре «Брукер» WP-80 с рабочей частотой 20,115 МГц. Условия регистрации: широкополосное подавление по ядрам ‘Н, объем памяти на накопление 8 К, иа воспроизведение 8 К, машинное разрешение 0,46 Гц, длительность импульса 3,2 мкс (25 °С), время сбора данных 1,092 с, температура образца 35—40 °С.
Ароматические углеводороды фракции 350—540°С содержат наибольшее число алкильных групп нормального строения состава С4, С5, С6 и С7 (табл. 8.16, №№ 1—4); не исключено присутствие длинных алкильных групп, которые этим методом не определяются. Велико также содержание разветвленных алкильных групп с метальным заместителем в цепи (№ 5—14). Выло обнаружено присутствие в углеводородах значительного количества алкильных групп изопренанового строения (№№ 15 и 16) и возможных их фрагментов (№№ 17—18). Обнаружены
Таблица 8.16. Среднее число алкильных групп на 100 средних молекул ароматических углеводородов (ЯМР 13С)
| Ароматические углеводороды | |||
| Ке по пор. | .Алкильная группа |
фракции 350—540 °С |
полученные дегидрированием нафтенов |
| 1 |
СН3СН2СН2СН2- |
75 | 75 |
|
2 |
СН3СН2СН2СН2СН2- | 64 | 69 |
| 3 |
СН3СН2СН2СН2СН2СН2- | 37 | 37 |
| 4 |
СН3СН2СН2СН2СН2СН2СН2— | 37 | 37 |
| 5 |
СН3СНСН2СН2СН2- 1 СНз | 6 | 6 |
| 6 |
сн3снсн2сн2сн2сн2- 1 СНз | 2,5 |
3,5 |
| 7 |
СНзСН2СНСН2- 1 СНз | 8 | 7 |
|
8 |
СНзСН2СНСН2СН2- 1 СНз | 6 | 7 |
| ¦9 |
СН3СН2СНСН2СН2СН2- 1 СНз | 4 | 5 |
| 10 |
СНзСН2СН2СН— 1 СНз | 7 | 6,5 |
|
11 |
СНзСН2СН2СНСН2- 1 СНз | 5,5 | |
| 12 |
СНзСН2СН2СНСН2СН2- 1 СНз | 4,5 |
5,5 |
| 13 |
СНзСН2СН2СН2СН- 1 СНз | 4,5 | 4 |
| 14 |
СН3СНаСН2СН2СНаСНСНа- 1 СНз | 4,5 |
5,5 |
| 15 |
CHgCHCH2CH2CH2CHCHa— 1 СНз СНз | 2 | 2,5 |
| 16 | —СН2СНС Н2СН2СН2СНСН2-СНз | 7 | 10 |
| Ароматические углеводороды | |||
| Ns по пор. |
Алкильная группа | фракции 350—540 °С | полученные дегидрированием нафтенов |
| 17 |
—СН2СН2СНСН2—сн2-1 СНз |
25,5 | 36,5 |
|
18 | -СН2СН2СН2СНСН2СН2СН2- 1 СНз | 11 | 15,5 |
| 19 |
—СН2СНСН2-1 СН2 1 СНз | 1,5 | 3 |
также алкильные группы с этильным заместителем в цепи (№ 19).
Как видно из табл. 8.16, ароматические углеводороды фракции 350—540°С содержат также короткие алкильные группы Ci — С3, главным образом метильные.
Как было установлено масс-спектральным анализом, концентрат изоалканов и нафтенов содержит 33,5,% изоалканов и 66,5 % нафтенов с числом циклов в молекуле от одного до шести. Молярное содержание изоалкан’ов и нафтенов во фракции 350—540 °С приведено ниже, %:
Для дальнейшего исследования нафтенов концентрат смесет изоалканов и нафтенов подвергали дегидрированию. Предполагали, что часть нафтенов, содержащих циклогексановые кольца, будет дегидрироваться с образованием ароматических углеводородов, по строению которых можно судить о строении исходных нафтенов.
Дегидрирование проводили в жидкой фазе при 330 °С в присутствии платинированного угля, содержащего 18 % Pt » 2 % Fe. Вводили 2 г катализатора на 10 г концентрата (20 % от массы концентрата). Дегидрирование проводили трехступенчато. После каждой ступени полученные арены отделяли от недегидрированной части углеводородов хроматографией на силикагеле. В результате трехступенчатого дегидрирования и хроматографического разделения получили 52,7 % ароматических углеводородов и 46,3 % углеводородов, содержащих изо-алканы и недегидрирующиеся нафтены.
Определенный методом масс-спектрометрии групповой состав аренов', полученных дегидрированием, показан в табл. 8.15. Из табл. 8.15 и 8.16 следует, что ароматические углеводороды, пол ученные дегидрированием нафтеновых углеводородов фракций 350—540 °С, по строению близки к ароматическим углеводородам исходной фракции 350—540°С. Распределение углеводородов по типам (с одним, двумя, тремя и четырьмя бензольными кольцами) практически одинаково. В обоих случаях преобладают арены с одним бензольным кольцом (57,8 и 65,2 %).
Весьма близко также строение и содержание алкильных групп в ароматических углеводородах фракции и ароматических углеводородах, которые получаются дегидрированием нафтенов.
В табл. 8.17 приведено среднее содержание атомов углерода в различных структурных фрагментах ароматических углеводородов фракции 350—540 °С и ароматических углеводородов, полученных дегидрированием нафтенов этой фракции, по данным ЯМР 13С-спектроскопии. Для определения бензольных колец спектры растворов углеводородов в дейтерохлороформе (с добавлением ацетилацетоната хрома(Ш) в количестве 0,2 моль/л) снимали с задержкой 3 с, длительностью импульса 11 мкс (90 °С), временем сбора данных 0,546 с, объемом памяти на накопление и воспроизведение — 4 К.
Полученные данные также свидетельствуют об аналогии в строении аренов обоих типов, а следовательно, об аналогии в строении аренов и нафтенов исходной фракции.
Таким образом, во фракции 350—540 °С содержатся моно-, би-, три-, тетра- и пентациклические нафтены, включающие кроме моноциклических углеводородов конденсированные си-
Та бл ица 8.17. Среднее содержание атомов углерода, %, в различных структурных фрагментах ароматических углеводородов фракции 350—540 °С и ароматических углеводородов, полученных дегидрированием нафтенов этой фракции (ЯМР 13С)
| Фрагмент |
Ароматические углеводороды | |
| фракция 350-540 °С |
полученные дегидрированием нафтенов | |
| Алкильные группы С[—Сз | 8,7 |
10 |
| (в основном метильные) | ||
| Алкильные группы более С3 | 29,2 | 34,7 |
| Нафтеновые кольца |
26,1 | 25,4 |
| Бензольные кольца |
36,0 | 29,9 |
Таблица 8.18. Характеристика нафтеиов, содержащихся во фракции 350—540 °С западносибирской нефти
| Чнсло колец | ||
| Нафтены |
циклогекса- | циклопента |
| новых |
новых | |
стемы из циклогёксановых и циклопентановых колец с алкильными заместителями нормального и разветвленного строения, в том числе изопренановыми (табл. 8.18).
Были также исследованы более широкие фракции нефти (табл. 8.19),
Таблица 8.19. Состав вакуумного газойля 230—500°С (I) и 210—570 °С (II) западносибирской иефти
| Показатель |
I | ГГ |
|
Плотность Р4° | 0,893 |
0,902 |
| Молекулярная масса | — | 400 |
| Пределы кипения фракции, °С | 230—500 |
310-570 |
| Массовое содержание серы, % Массовый углеводородный состав, % | 1,27 |
1,62 |
| Алканы |
24,2 | 17,4 |
|
изастроення | 18,6 |
13,2 |
| «-строения | 5,6 | 4,2 |
| Нафтены | 24,7 |
21,1 |
|
моноциклические | 7,6 |
6,7 |
|
бициклические | 6,7 |
5,5 |
| трицикл ические | 4,5 | 3,6 |
| тетрацикл ические | 4,0 | 3,4 1,9 |
| п е ита циклич ески е | 1,9 |
|
Показатель | I | и |
| Арены |
48,6 | 54,5 |
| м о ноцикл ические |
21,7 | 16,9 |
| алкнлбеизолы |
10,1 | 8,3 |
| инданы, тетралины |
8,5 | 5,5 |
|
дннафтенбензолы |
3,1 | 3,1 |
|
бициклические | 9,7 | 13,3 |
|
нафталины | 4,3 |
4,6 |
|
мононафтеннафталины |
4,2 | 5,7 |
|
динафтеннафталины |
1,2 | 3,0 |
|
трициклические | 10,5 | 13,8 |
|
фенантрены | 5,9 |
7,1 |
|
мононафтенфенантрены |
2,2 | 4,3 |
|
дииафтенфеиантрены |
2,4 | 2,4 |
|
тетрациклические |
0,1 | — |
|
пирены, хризены | 0,1 | — |
|
гетероциклические |
6,6 | 10,5 |
| бензгиофены | 4,6 | 4,7 |
|
днбензтиофены | 0,6 | 3,4 |
|
нафтобензтиофены |
1,4 | 2,4 |
|
Смолы | 2,4 |
7,0 |
В широких фракциях вакуумного газойля западносибирской нефти (I и II) содержание нафтенов с числом циклов 1—5 составляет 21,1—24,8, алканов—17,4—24,2, а аренов — 48,6—
54,5 %.
8.5. СВОЙСТВА ЦИКЛОАЛКАНОВ
Основные физические свойства циклоалканов приведены в табл. 8.20. Температуры кипения циклоалканов выше температуры кипения алкенов или алканов с тем же числом атомов углерода в молекуле. Плотность соединений этой группы выше плотности соответствующих н-алканов, но ниже плотности аренов, Это свойство иногда используется для определения группового состава фракций нефти. Наличие радикалов-заместите-
Цнклоалкаи
Циклопентан Метилциклопента н Этилциклопентан
1.1 - Диметилциклопентан цис-l, 2-Днметилциклопентан транс-1,2-Диметилциклопентан
1.3-Диметилциклопентан Пропилциклопентан Изопропилциклопентан
цис-1,2-Метилэтилциклопентан транс-1,2-Метилэталциклопентаи
1.3-Метилэтилциклопентан Бутилциклопентан Изоамилцнклопентан Циклогексан Метилциклогексан Этилциклогексан
1.1 - Диметилциклогексан Чис-2,2-Диметилциклогексан транс-1,2-Диметилциклогексан цис-1,3-Диметилциклогексан транс-1,3-Дим етилциклогеисан цис- 1,4-Диметил циклогексан транс- 1,4-Днметил циклогексан Пропилциклогексан Изопропилциклогекеан
1.2-Метилэтилцнклогексаи
1.3-Метилэтилциклогекеан
1.4-Мет илэтилциклогексан
Бутилциклогексан Амнлцнклогеисан Циклогептан Циклооктан Циклононан Циклодекан Циклододекан Циклотетрадекан Циклопентадекан Циклогенса дека н Циклогептадекан Циклогексакозан Циклотриаконтан Цнклотетратриаконган _
| W “с | *кнп' °С | ps#, кг/м3 | п D |
| —94,4 | 49,3 |
745,4 | 1,4064 |
| — 142,7 | .71,9 |
748,8 | 1,4099 |
|
— 137,9 | 103,4 | 765,7 | .1,4197 |
| —76,4 | 87,5 | 752,3 |
1,4126 |
| —52,5 |
99,2 | 772,3 | 1,4276 |
| — 120,0 | 91,9 | 751,9 | 1,4120 |
| — 136,7 | 90,7 |
745,6 | 1,4076 |
| — 120,3 | 130,8 | 775,6 |
1,4265 |
| —112,7 | 126,8 | 776,6 |
1,4265 |
| — |
128,2 | 785,0 | — |
| — | 121,4 |
769,1 | — |
|
— | 120,7 | 766,9 |
1,4210 |
| — 108,2 |
156,8 | 784,3 | 1,4315 |
| — | 169,0 |
784,0 | 1,432 |
|
-6,5 | 80,8 | 778,1 |
1,4264 |
| — 126,3 |
100,8 | 769,2 | 1,4230 |
| —114,4 | 132,0 | 777,2 | 1,4324 |
| —34,1 | 120,5 |
784,0 | 1,4293 |
|
—50,1 | 128,0 | 796,5 | 1,4333 |
| —89,4 | 125,0 . | 776,0 |
1,4303 |
| —86,0 |
121,0 | 783,5 | 1,4260 |
| —79,4 | 119,0 |
762,0 | 1,4254 |
|
—85 | 121,7 | 767,1 | 1,4230 |
| —33,5 | 119,6 | 765,5 |
1,4205 |
| —94,5 |
154,7 | 793,2 | 1,4371 |
| —89,8 | 154,5 |
799,2 | 1,4410 |
|
— | 153,6 | 805,0 |
1,4400 |
| — |
155,5 | 791,0 | 1,4344 |
| -78,6 | 151 |
789,0 | 1,4343 |
|
— | 179 | 799,7 |
1,4412 |
| — |
204 | 804,0 | 1,4428 |
| — 12 | 117 |
810,0 | _ |
|
14,2 | ,146 | 839,0 |
_ |
| — |
170 | _ | |
| 9,6 | 201 | _ | _ |
| 61 |
— | _ |
___ |
| 53 |
_ | __ |
___ |
| 37 |
— | _ | ___ |
| 57 | _ |
_ | __ |
| 63 | — | _ | _ |
| 43 |
— | 847,0 |
___ |
| • 56 |
— | 854,0 | _ |
| 66 | — |
856,0 | _ |
лей резко снижает температуру плавления углеводорода, и тем значительнее, чем • меньше углеродных атомов содержит алкильный заместитель.
По физическим и химическим свойствам циклоалканы можно условно разделить на следующие группы: с малыми
(Сг—С4), обычными (С5, Ce, С7), средними (Се—Ci2) и большими циклами (>Ci2).
Химические свойства циклоалканов изменяются под влиянием углового (байеровского) напряжения.
Циклопропан и циклобутан в нефтях не содержатся.
Многие химические свойства циклоалканов напоминают свойства алканов. Они вступают в реакции замещения, например с галогенами, нитруются азотной кислотой. Концентрированная серная кислота практически не растворяет циклоалканы (С5 и выше), олеум и хлорсульфоновая кислоты реагируют с ними с выделением SO2.
Циклоалканы С5 и Се достаточно устойчивы, однако под влиянием хлорида и бромида алюминия подобно алканам претерпевают изомеризацию, причем происходит расширение или сужение цикла. Так, циклогексан превращается при 30—80 °С в метилциклопентан. Реакция не протекает количественно слева направо: она остановится в момент, когда состав смеси соответствует 75 % циклогексана и 25 % метилциклопентана. Пяти-и шестичленные углеродные циклы образуются значительно легче, чем меньшие и большие циклы. Поэтому в нефтях обнаружены многочисленные производные циклогексана и цикло-пентана, в то время как производные остальных циклоалканов встречаются реже.
Нормальный угол между двумя валентностями насыщенного атома углерода (с гибридизацией sp3) равен 109°28'. Как установлено Байером в 1885 г., в циклоалканах валентности углерода отклоняются от их нормальной ориентации, вследствие чего возникает напряжение в цикле, энергия молекулы возрастает. В трехчленном кольце циклопропана каждая валентность имеет отклонение от нормального направления на 24°44', в четырехчленном— на 9°44', в циклопентане — на 0°44', в цикло-гексане на —5°16', но молекула циклогексана не является плоской, и в ней отсутствуют напряжения.
Устойчивость различных циклов видна из сравнения, теплот сгорания (табл. 8.21). Так, теплота сгорания наиболее устойчивого циклоалкана — циклогексана — в расчете на группу СНг (659,03 кДж/моль) почти совпадает с теплотой сгорания группы СНг алифатических углеводородов. Циклопентан менее устойчив, чем циклогексан.
Кроме байеровского в ряде случаев проявляется напряжение заслонения (торсионное, или литцеровское), обусловленное вынужденным отклонением от наиболее выгодной нечетной кон-
Избыток теплоты сгорания по сравнению с циклогексаном, кДж/моль
Теплота сгорания, кДж/моль
Циклоалкан
н а группу СН2
на молекулу
на молекулу
Циклопентан
Циклогексан
Циклогептан
Циклооктан
Циклононан
Цнклодекан
Цнклопентадекан Цнклогепта декан
.5,45
0
3,77 5,03 5,45 4,61 — 1,26 — 1,67
9866,55 657,77 —18,90
11175,12 657,36 —28,39
Питцеровское напряжение сильно снижается в неплоской молекуле циклопентана. Циклопентан существует в двух конформациях: «конверта» и «полукресла». На рис. 8.4 изображены эти конформации в трех проекциях. В проекциях 1 и 1' указаны величины (в нм) выхода атомов углерода из средней плоскости кольца; 2, 2' и 3, 3' — проекции на эту плоскость.
формации, что схематически изображается следующим образом:
Атомы углерода циклопентана не занимают жестко закрепленного положения, кольцо как бы находится в постоянном волнообразном движении —псевдовращении.
Для обозначения пространственного расположения замести-
-0,05
Рис. 8.4. Конформация циклопентана в трех проекциях 228
телей в стереоизомерах ряд авторов использует систему отсчета расположения заместителей относительно какого-нибудь радикала, обычно с цыс-ориентацией. По этой номенклатуре изображенный ниже изомер называется цис,цис,транс-1,1-1,1-ди-метил-3-этилциклопентаном:
¦СНз
Ал. А. Петров использует другой тип номенклатуры, по ко-. торой взаимное расположение заместителей отсчитывается попарно от каждого предыдущего с каждым последующим заместителем. В этом случае приведенный выше углеводород следует назвать ^ис,цыс-1,2-диметил-3-этилциклопентан. Этот способ позволяет сразу видеть количество цис- (или транс-) ви-цинально расположенных пар заместителей (у срседних углеродных атомов), что определяет совокупность физических и ряда химических свойств пространственных изомеров.
Имеющиеся в литературе экспериментальные данные по свойствам 1,2-диалкилциклопентанов позволяют считать доказанным, что среди углеводородов состава С7—Сю температуры кипения стереоизомеров подчиняются правилу Ауверса—Скита, по которому они выше для цыс-изомеров.
Согласно основному положению конформационного анализа— принципу минимального отталкивающего взаимодействия несвязанных атомов — энергия взаимодействия атомов боковых заместителей (в углеводородах это атомы Н в замещающих радикалах) является основным фактором, определяющим относительную термодинамическую устойчивость стереоизомеров:
транс-
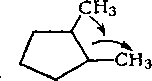
В ц«с-изомере 1,2-диметилциклопентана наблюдается перекрывание вандерваальсовых радиусов алкильных заместителей, а в транс-изомере — нет.
1,3-Дизамещенные циклопентаны также существуют в виде двух пространственных изомеров: цис- и транс-. В обоих изомерах отсутствуют взаимодействия несвязанных между собой
атомов, поэтому термодинамическая устойчивость этих изомеров практически одинакова:
СН3
СН3
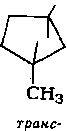
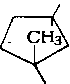
цис-
Пространственную стереоизомерию в три- и тетраалкилцик-лопентанах удалось установить совсем недавно.
В общем случае при разных или несимметрично расположенных заместителях 1,2,3-триалкилзамещенные циклопентаны могут иметь четыре пространственных изомера, составляющие три группы:
СН3/СН3 СН3
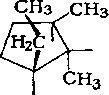
транс, транс-I группа
СНз
НзС-
транс, цис-II группа
цис, транс’ цис, цис-
III группа
_/СН3
cTYch3
Н3С>Н2
Принадлежность того или иного изомера к определенной группе обусловлена взаимным положением вицинальных заместителей. Изомеры, выкипающие раньше й, следовательно, принадлежащие к первой группе, должны иметь, в соответствии с правилом Ауверса — Скита, транс-положение вицинальйых заместителей.
1,2,3,4-Тетраалкилциклопентаны существуют в виде восьми пространственных изомеров. В случае одинаковых заместителей их число равно шести. Все изомеры можно разбить на четыре группы, в которых изомеры каждой последующей группы отличаются от изомеров предыдущих групп нэ одну пару цис-вици-нально расположенных заместителей. Наиболее устойчивыми являются стереоизомеры, не имеющие ^ыс-вицинальных взаимодействий. Далее по устойчивости располагаются изомеры с одним таким взаимодействием, затем — с двумя и, наконец, с тремя.
Молекулы циклогексана при комнатной температуре существуют практически только в кресловидной форме. Методами ИК-спектроскопии, анализом спектров комбинационного рассеяния и дифракции электронов доказано, что однозамещенные производные циклогексана обладают практически только эква-
ториальной конформацией е (С—Н связи ориентированы близко к плоскости кольца), аксиальные стереоизомеры а (С—Н связи ориентированы параллельно оси кольца) отсутствуют.
Дизамещенные соединения циклогексана существуют каждое в двух конформациях: цис- и транс-. У транс- 1,2-диметил-циклогексана конформация е,е более устойчива. У цш>1,2-диме-тилциклогексана единственно возможной является конформация а,е. Следовательно, транс-1,2-диметилциклогексан устойчивее цыс-изомера. Аналогичное положение наблюдается и у цис,транс-изомеров 1,4-диметилциклогексана. В случае 1,3-ди-замещенных производных циклогексана цыс-изомер (конформация е,е) устойчивее транс-изомера (а,е).
У полизамещенных производных циклогексана возможна более сложная конформационная изомерия. Из-за легкости инверсии кольца полизамещенные циклогексаиы имеют такую конформацию, при которой число аксиально ориентированных заместителей наименьшее. Переход заместителя из аксиального положения в экваториальное сопровождается энергетическим выигрышем.
Увеличение числа цыс-вицинальных взаимодействий неизменно ведет к уменьшению термодинамической устойчивости сте-. реоизомеров. В то же время увеличение общего числа заместителей заметно повышает относительную устойчивость изомеров, имеющих цыс-вицинальные взаимодействия, и снижает устойчивость углеводородов, не имеющих таких взаимодействий.
В углеводородах ряда циклогексана фактором, определяющим устойчивость стереоизомеров, является число аксиально ориентированных заместителей в кольце. По мере увеличения числа аксиальных заместителей устойчивость стереоизомеров падает. В то же время относительная устойчивость стереоизомеров с одной-или двумя аксиальными груп-
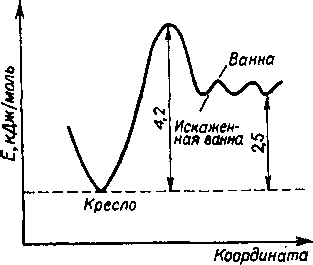
Рис. 8.5. Энергетика коиформациои-иых превращений циклогек-саиа
пами по мере увеличения общего числа заместителей в кольце несколько возрастает.
Потенциальный барьер, разделяющий формы кресла и ванны циклогексана (данные ЯМР), равен 42—46 кДж/моль (рис. 8.5). В молекуле циклогексана пространственное расположение двух пар атомов в основании ванны (С = 1 и С = 6, С = 3 и С = 4) сопровождается увеличением потенциальной энергии. Кроме того, конформация ванны невыгодна и потому, что в ней происходит отталкивание пары атомов водорода, находящихся в вершинах ванны:
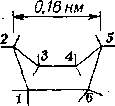
Однако форма ванны обладает гибкостью, подвижностью и может принять конформацию искаженной ванны (твист-форма), которая энергетически несколько выгоднее, так как в ней нет полностью заслоненных конформаций.
В средних циклах (8—-12 звеньев) нет углового (байеров-ского) напряжения, и они построены из нечетных конформаций, т. е. питцеровского напряжения в них тоже нет. Причина повышенной энергии этих циклов — «внутримолекулярная теснота», которая приводит к тому, что несвязанные атомы располагаются на расстояниях, меньших сумм их вандерваальсо-вых радиусов (прелоговское напряжение).
Одна из важных отличительных особенностей средних циклов (на примере циклодекана) —возможность таких конформаций, в которых часть связей углеродных атомов направлена внутрь кольца. Такие связи называются интранулярными; связи, расположенные снаружи кольца, — экстрануляр-ными, Циклодекан в своей наиболее выгодной конформации имеет 6 интранулярных и 14 экстранулярных атомов водорода. Следовательно, группы СНа циклодекана неравноценны: среди них есть группы, у которых оба атома водорода экстранулярны, а также такие, у которых один Н-атом экстранулярен, другой интранулярен. Кроме того, два последних типа СНг-групп различаются и тем, что в одном случае экстранулярный водород экваториален, в другом — аксиален. Таким образом, именно ин-транулярные атомы водорода и создают «внутримолекулярную тесноту» и ответственны за повышение энергии молекулы цик-лодекана.
Циклы с числом звеньев больше 12 обладают большей кон-формационной подвижностью. В этом случае вследствие почти свободного вращения вокруг связей С—С здесь не могут существовать цис,транс-изомеры; трудно зафиксировать и определенные конформации. Считается, что большие циклы существуют в основном в виде вытянутых прямоугольников, составленных из зигзагообразных конформаций.
Устойчивость молекул циклоалканов можно рассмотреть исходя из принципа сохранения системой минимума свободной энергии их образования (энергии Гиббса). С изменением длины цепи циклоалкана на одну СНггруппу происходит изменение свободной энергии молекулы на 8,60 кДж при 300 К.
Ниже приведены значения свободной энергии образования циклопентана и его замещенных при 300 К, кДж/моль:
1 -транс-2-Диметил- 39,44 Децилциклопеитаи 114,43
циклопентан Гексадецилциклопентаи 166,01
Значения свободной энергии образования циклопентана и его производных находятся в хорошей корреляции с действительным содержанием этих соединений в легких фракциях нефтей (см. табл. 8.3).
Основные реакции циклоалканов. Как и для алканов, здесь приведены лишь наиболее важные реакции.
Действие азотной к и с л о т ы. Первичные нитросоединения образуются только при наличии метильной группы в боковой цепи циклоалканов. Скорость нитрования третичного углеродного атома выше, чем вторичного, а так как в нафтенах содержится наряду с третичными атомами углерода много вторичных, обычно получаются вторичные и третичные нитросоединения. Одновременно идут реакции окисления с разрывом кольца и образованием двухосновных кислот. При этом замещенные моноциклические циклоалканы при окислении отщепляют боковые цепи.
Процесс нитрования циклогексана приобрел промышленное значение в связи с разработкой метода получения капролак-тама из циклогексана через нитроциклогексан. Нитрование циклогексана в жидкой фазе осуществляют при повышенном давлении, температуре 200 °С и времени контакта 7—8 ч. При парофазном нитровании поддерживают температуру 380—400 °С, время контакта 1—2 с. Выход мононитроциклогексана 60, ди-карбоновых кислот— 20 %.
Разработан способ получения капролактама фотонитрозиро-ваиием циклогексана с помощью нитрозилхлорида, получаемого
из нитрозилсерной кислоты по реакциям:
2NH3 + 302 —> N2O3 + ЗНгО;
N203 + 2H2S04 —> 2HN0S04 + H20; HN0S04 + HC1 —> N0C1+H2S04;
NOH • 2HC1
(^j + NOCl +HC1 —>
;0
NOH • 2 HC1
6
олеум

;nh + 2hci.
Окисление. Практически весь капролактам идет на получение найлона-6, который наряду с его предшественником найлоном-6,6 является одним из важнейших полиамидов, используемых в производстве синтетических волокон.
Вначале основным сырьем для производства капролактама был фенол. Однако затем доминирующее положение занял циклогексан. В настоящее время существует семь промышленных методов производства капролактама, несколько методов находятся на стадии разработки.
Первой стадией почти во всех методах является окисление циклогексана кислородом в смесь циклогексанола и циклогек-санона, второй — окисление этой смеси в адипиновую кислоту (см. схему 8.3).
Указанная схема не исчерпывает всего многообразия промежуточных реакций, имеющих место при окислении циклогексана.
В зависимости от условий процесса, вида и концентрации катализатора, наличия примесей в циклогексане и других факторов, количественное соотношение между продуктами, образующимися различными путями, может существенно меняться.
Каталитическая активность металлов переменной валентности при окислении циклогексана убывает в ряду:
Со > Сг > Мп > Fe > А1 > РЬ.
В промышленности применяют в основном нафтенаты, лау-ринаты, стеараты кобальта и марганца (CoSt2, CoSt20H, MnSt2).
Катализатор в этом процессе выполняет, три функции: инициирование цепей, их обрыв и регулирование состава продуктов.
Инициирующая функция соли металла переменной валентности обусловлена образованием свободных радикалов в основ-
Схема 8.3. Окисление циклогексана
ном в результате взаимодействия катализатора с гидропероксидом, спиртом или кетоном:
СНз (СН2)4 соон
1 ! 1
НОО 0 0 о
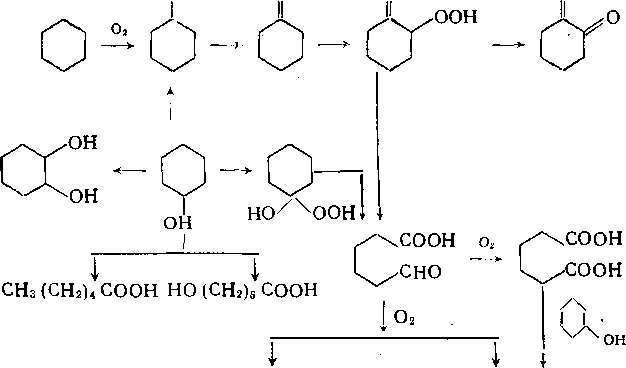
низшие моио-и днциклогекснл-
моно-н дикарбоновые адипииаты
кислоты (Сг—С6)
ROOH +CoSt2 —>- CoSt2OH + RO-;
ROOH + CoSt2OH —> CoSt2 + H20 + R02 •;
^>CHOH + CoSt2OH —> ^>COH + CoStj + H20.
Восстановленная форма катализатора реагирует не только с молекулярными продуктами, но и со свободными радикалами, обрывая цепи. Катализатор заметно изменяет соотношение образующихся циклогексанола, циклогексанона и идипиновой кислоты— основных продуктов процесса.
С использованием стеаратов кобальта, марганца и меди наблюдается последовательно-параллельное образование спирта, кетона и гидропероксида, а в присутствии стеарата церия — только последовательное.
Параллельное образование данных продуктов объясняется взаимодействием катализатора с пероксидными радикалами с образованием молекулярных продуктов:
CoSt2OH + R02 • ROOCoStsOH —> ROH + CoSt2 + 02.
где St — кислотный остаток стеариновой кислоты.
При использовании в качестве катализаторов соединений V(IV), Cr(III), Mo(VI) селективность окисления циклогексана в циклогексанон значительно повышается по сравнению с селективностью промышленного процесса (на CoSta). Эти катализаторы не взаимодействуют с пероксидными радикалами, а высокий выход кетона обусловлен селективным разложением гидропероксида циклогексила в основном молекулярным путем в циклогексанон (выход до 94 %)•
Циклогексанол и циклогексанон выделяют из реакционной смеси и затем циклогексанол дегидрируют в кетон. Последний оксимируют и далее переводят в капролактам:
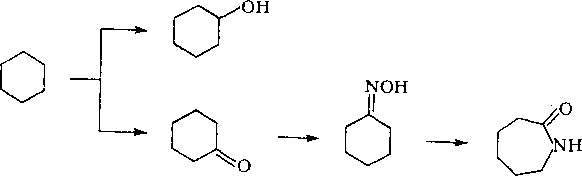
Разработаны лабораторные и осваиваются опытно-промышленные или промышленные способы окисления метилцикло-пентана, метилциклогексана, изомерных диметилциклогексанов, циклододекана. При этом получается целая гамма ценных кислородсодержащих соединений: циклических гидропероксидов, спиртов, кетонов, моно- и дикарбоновых кислот нормального и разветвленного строения, лактонов и ряда других соединений.
Пербромирование. Реакция пербромирования по Гу-ставсону—Коновалову, проводимая в присутствии АШгз, является классической при определении' циклоалканов, в том числе и сложной (гибридной) структуры. Предварительно из исследуемой фракции сульфированием удаляют алкены и арены, а затем смесь циклоалканов и алканов обрабатывают бромом:
AIBrj
СНзСвН„ + 8Вг2 -» СН3СвВг5+ИНВг.
Происходит полное замещение всех атомов водорода бромом с образованием бромзамещенного ароматического соединения.
Замещение. Так как циклоалканы, начиная с цикла Cs, относительно свободны от напряжения, то связи С—С в них обладают малой реакционной способностью. Эти соединения сходны по свойствам с алканами. Однако реакции замещения, например хлорирование циклопентана и циклоалканов с большим кольцом, протекают менее сложно. Это связано с меньшей вероятностью образования изомерных продуктов замещения жестко ориентированных циклоалканов. Так, хлорирование циклогексана приводит только к монопроизводному, а гексана— к трем изомерным монохлорпроизводным.
Термическое воздействие. При термическом воздействии на циклопарафины протекают реакции, сопровождающиеся разрывом углерод-углеродных связей в боковых цепях и кольце, деструктивная гидрогенизация и в небольшой степени ароматизация. Механизм этих реакций описан в гл. 12.
Каталитическое превращение циклоалканов. В 1911 г. Н. Д. Зелинский открыл реакцию каталитического дегидрирования циклоалканов:
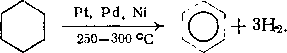
Аналогично при дегидрировании метилциклогексана образуется толуол, из этилциклогексаиа— этилбензол, из деметил-циклогексана — ксилол. Метилциклопентан изомеризуется вначале в циклогексан. Ароматизация алкилциклопёнтанов и ал-килциклогексанов облегчается с возрастанием их молекулярной массы.
В зависимости от условий и катализатора происходят следующие реакции.
1. Перераспределение водорода между молекулами одного и того же вещества:
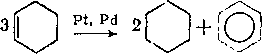
Реакция идет с выделением теплоты в присутствии платинового или палладиевого катализатора при комнатной температуре. Эти реакции играют значительную роль при дегидрировании циклоалканов и при гидрировании аренов. Так, винилцик-логексен дает смесь этилциклогексаиа и этилбензола:
¦СН = СНг
— 2
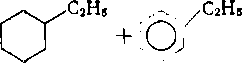
а
3
2. Перераспределение водорода между молекулами различ-ныщ веществ. В этих реакциях молекулы одних веществ являются донорами водорода, а молекулы других—акцепторами.
Донором является циклоалкан, а акцепторами алканы и ал-кены:
О
![]()
+ 3RCH == СН2 —> + 3RCH2CH:
Реакция ускоряется платиной, палладием, никелем, медью — типичными катализаторами гидрирования по углерод-углерод-ным связям. Эти реакции протекают при каталитическом крекинге на алюмосиликатах (см. гл. 13).
3. Внутримолекулярное перераспределение водорода. Эта реакция происходит в результате изомеризации, но не на катализаторах кислотного типа, а на дегидрогидрирующих катализаторах:
СН = СН:
СН2СНз
этилцнклогексен
винилциклогексан
При термокатализе идут реакции изомеризации нафтеновых углеводородов с образованием наиболее устойчивых изомеров:
![]()
дициклопентан
О
Существует три вида изомеризации циклоалканов: структурная скелетная без изменения числа атомов углерода в цикле
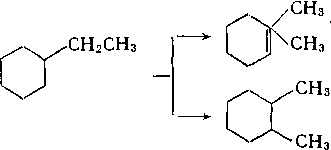
структурная скелетная с изменением цикла
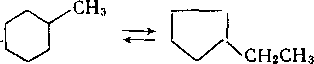
пространственная геометрическая, или транс-цис-
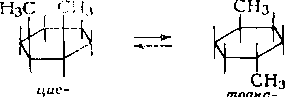
транс-
В присутствии кислотных катализаторов при 0—140 °С процесс изомеризации циклоалканов сопровождается образованием карбкатионов:
катализатор r^V"vi+ катализатор
—*и-'
На бифункциональных катализаторах при 240—420 °С на гидрирующе-дегидрирующих металлических центрах образуются циклоалкены, а на кислотных — карбкатионы:
Изомеризация семичленных и десятичленных циклов приводит к образованию соответствующих устойчивых декалинов. Механизм этого процесса, а также превращений циклоалканов при каталитическом риформинге изложен в гл. 13.
8.6. МЕТОДЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ
Циклоалканы нашли широкое применение в промышленности, однако процесс выделения индивидуальных соединений этой группы из нефти сложный и дорогой, поэтому их получают синтетическими методами.
Циклогексан получают главным образом гидрированием бензола на никелевом катализаторе при 140—200°С и давлении 1—5 МПа:
При синтезе мономеров для производства полиамидных волокон используют циклоалканы с числом углеродных атомов больше шести (циклогептан, циклооктан, циклододскан).
Циклогептан можно синтезировать из циклопентадиена
С С С
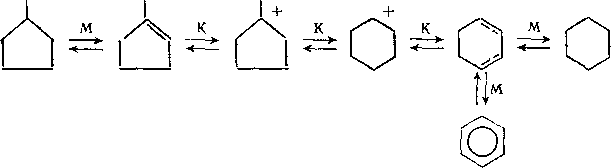
здесь М — металлические центры; К — кислотные центры.
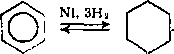

П-
![]()
и ацетилена пиролизом первичного аддукта и последующим гидрированием циклогептадиена:
Циклооктан можно получить циклополимеризацией ацетилена по Реппе:
Значительно выгоднее для этой цели использовать 1,3-бутадиен:
Циклододекан получается при гидрировании циклического тримера бутадиена:
1,5,9-циклододекатриеи
Гидрирование циклоалкенов на никелевом катализаторе (носитель А120з) протекает при 100 °С с количественным выходом.
Тетралин и декалин получают гидрированием нафталина с никелевым катализатором соответственно в паровой и жидкой фазах.
Существует ряд лабораторных методов получения циклоалканов, которые хорошо описаны в учебниках по органической химии и здесь не рассматриваются.