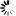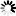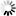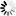Отклонение углеводородных газов от физических законов
Глава III
ОТКЛОНЕНИЕ УГЛЕВОДОРОДНЫХ ГАЗОВ ОТ ФИЗИЧЕСКИХ ЗАКОНОВ
Рассмотренные выше законы газового состояния справедливы только для идеальных газов, для реальных же газов эти законы являются приближенными.
Отклонение от закона Бойля-Мариотта впервые было установлено вконце XVIII в. фон-Морумом,который, изучая аммиак, нашел, что он сжимается сильнее воздуха.
В1847 г. Реньо, экспериментально проверяя закон Бойля-Мариотта, установил, что этот закон является приближенным и что все газы, кроме водорода, сжимаются больше, чем это следует из закона.
После этого многочисленными исследователями были даны характер и величины отклонения различных газов от закона Бойля-Мариотта. Установлено, что для небольших давлений отклонения незначительны, для высоких же давлений эти отклонения приобретают уже существенное практическое значение.
Применяемые давления в настоящее время в промышленностй при перекачке газа по газопроводам (до 50 am), при закачке газа в баллоны (до 200 am) или при закачке в пласт требуют внесения поправки на-отклонение газа от закона Бойля-Мариотта.
Процент отклонения природных газов от закона Бойля-Мариотта можно приближенно определить по формуле: 122
АТ __ 2,26P(M-ME+3y-f 0,22a) /lQv
1000 ’ '}
где N — процент отклонения;
Р — давление в ати;
М — процент метана в газе;
Е — процент этана в газе;
у — процент углекислоты в газе;
а — процент воздуха в газе.
Профессор Броун экспериментально определял сжимаемость природных газов и отклонение от закона Бойля-Мариотта. На основании этих данных он построил кривые, по которым величину отклонения можно определить двумя способами: а) по составу газа, б) по удельному весу газа по отношению к воздуху (фиг. 2).
В табл. 5 дан состав газа, для которого определено отклонение от закона Бойля-Мариотта и найдены средние критические давления и температура.
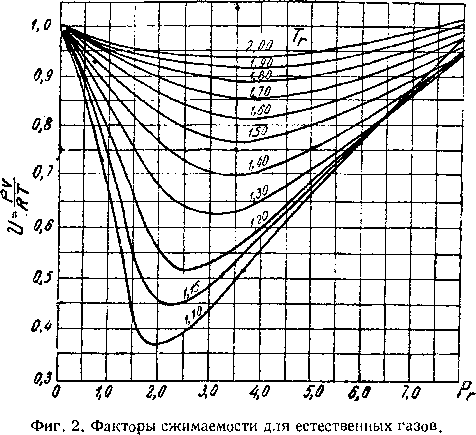
Таблица 5
Определение среднекритического давления и температуры
| Состав газа | Содержание в объемных процентах | Средний молекулярный вес |
Критич. давление каждого компонента | Критич. температура каждого компонента |
Среднеприве-денное критическое давление |
Среднеприве-денная критическая температура | |
|
наименование | фор- мула | ||||||
| Метан ........ | СН4 |
83,19 | 13,34 |
47,32 | 191 |
39,2 | 158,0 |
| Этан......... |
С2Нв | 8,48 | 2,55 | 49,78 |
305 | 4,2 |
ш |
| Пропан........ . | С3н8 |
4 3Ъ | 1,93 |
43,38 | 370 |
1,9 | 16,2 |
| Изобутан ...... |
iC4H10 | 0,76 |
0,44 | 38,25 |
407 | 0,3 |
3,1 |
| н-Бутан ... ..... | г?С4Нго |
1,68 | 0.98 |
3874 | 425 |
0,6 | 7,1 |
|
Изопентан ..... |
0,57 | 0,41 |
33,89 | 461 |
0,2 | 2,6 | |
|
я-Пентан....... |
лСбН12 |
0,32 | 0,23 |
34,1 | 470 |
0,1 | 1,5 |
|
Гексан ........ |
с6н14 | 0,63 | 0,54 | 30,52 |
508 | 0.2 |
3,2 |
|
100,00 | 20,42 |
46,7 | 217,5 | ||||
Примечания. 1. Колонка 7 получается от умножения колонок 3 и 5.
2. Колонка 8 получается от перемножения колонок 3 и 6.
Зная средние критические давление и температуру, находят приведенные давления и температуру, по которым, пользуясь кривыми, определяют коэфициент сжимаемости газа.
| ! & | 1 1 § ШО и | ||||||
| Г5 0,5 0,7 0,в 0,9 t,0 i. |
||||||
Уд. $6 с еазо по отмэшвни/о Л
Фиг. 3. Среднекритическая температура и удельный вес газа.
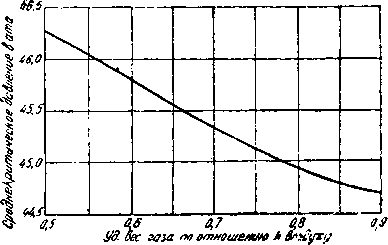
Фиг. 4. Среднекритическое давление и удельный вес газа.
Допустим, что нам требуется определить коэфициент сжимаемости указанного в табл. 5 газа для давления 50 am и температуры
30° С. Приведенное давление и температура будут:
Pr = W=1’07’ <14>
Тг = Ш7ъ=1’4- <15>
Из графика (фиг. 2) для найденных Рг и Тг и —0,87.
Отклонение от закона Бойля-Марриота будет в процентах
Если состав газа неизвестен, а известен только его удельный вес по воздуху, то по кривым проф. Броуна можно найти среднекритические давление и температуру, а по ним из графика (фиг. 2) определить сжимаемость газа и отклонение от закона Бойля-Мариотта.
Удельный вес по воздуху приведенного выше состава газа равен
0,705. Из кривой (фиг. 3) находим среднекритическую температуру Т скр= 214, а из кривой (фиг. 4) среднекритическое давление РСкР== =47,0.

Приведенные давление и температура будут:
Pr= U =1,064, (16)
7V=g= 1,414, (17)
тогда
и = 0,87 и N=15%,
т. е. оба определения дают одни и те же результаты.
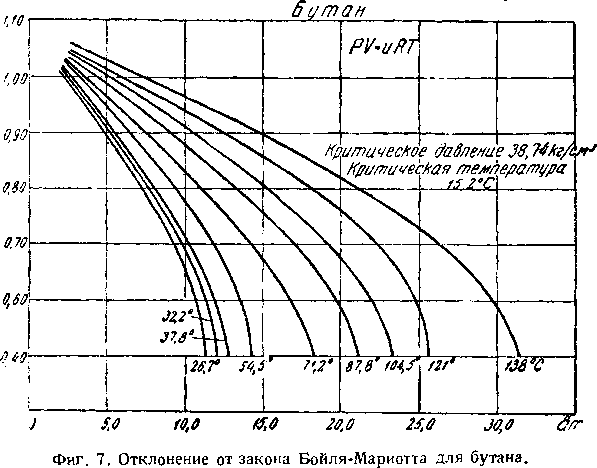
На фиг. 5, 6 и 7 приведены кривые отклонения от закона Бойля-Мариотта для этана, пропана и бутана.
К - A or/я баиля Мяри&тш* 2?~ Ofnk/tOt/erfitP от закона бойля-МариОТШ
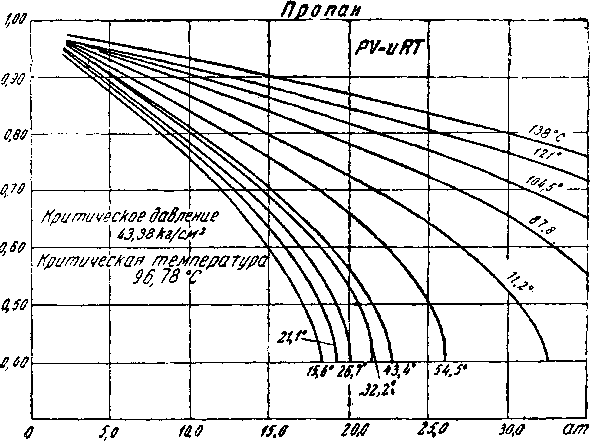
Фиг. б. Отклонение от закона Бойля-Мариотта для пропана