Осушка и очистка природного газа
ГЛАВА XVI
ОСУШКА И ОЧИСТКА ПРИРОДНОГО ГАЗА
Природный газ, предназначенный для транспорта по магистральным трубопроводам, должен содержать определенное количество влаги и сероводорода. Влажность газа обычно доводится до 9,5—12,5 кг на 1 млн. л3, а содержание сероводорода до 0,23 — 0,58 г на 100 м3.
Осушкой природного газа называется процесс удаления воды, находящейся в природном газе в парообразном состоянии. Общепризнано, что осушка газа является необходимым условием для обеспечения бесперебойной работы магистральных газопроводов. Она предотвращает образование гидратов и уменьшает коррозию. При транспорте влажного газа в определенных условиях влага может сконденсироваться и накапливаться в пониженных местах газопровода, вследствие чего уменьшается пропускная способность магистрали.
В газовой промышленности применяются несколько методов осушки: адсорбцией, абсорбцией, прямым охлаждением, сжатием с последующим охлаждением и химическая осушка.
Поскольку ни один из этих методов не обладает безусловным преимуществом по сравнению с остальными, для выбора наиболее эффективного и экономичного в конкретных условиях процесса необходимо знать все эти методы.
В процессах осушки путем адсорбции в качестве адсорбента чаще всего применяют активированную окись алюминия, силикагель и бокситы, а при осушке газа абсорбцией— диэтилен гликоль и триэтилен гликоль. Осушка газа охлаждением и химическими способами получила небольшое распространение, эти методы будут охарактеризованы лишь кратко.
Количество влаги в насыщенном природном газе уменьшается при увеличении давления или снижении температуры (рис. V. 8). Таким образом, теплый или горячий газ, насыщенный водяным паром, можно частично осушить путем прямого охлаждения. Газ после сжатия обычно охлаждают, вследствие чего из него удаляется вода. Если при охлаждении не достигается минимум температуры, которую газ будет иметь при дальнейшем движении по системе при данном давлении, конденсация влаги газа в дальнейшем не будет исключена. Использование эффекта Джоуля-Томпсона или охлаждение расширением в промысловых сепараторах с целью осушки природного газа описано в главе XIII.
Химическая реакция между водой и химическими веществами может быть столь полной, что образующиеся при ней продукты гидратации будут иметь чрезвычайно низкую упругость водяных паров. Имеются химические агенты, обеспечивающие практически полную осушку газа [XVI. 2]. Однако эти агенты очень трудно или вообще невозможно регенерировать. Это обстоятельство делает их непригодными для использования в качестве промышленных осушителей. Однако, как указывалось в главе V, они широко применяются при лабораторном определении влажности газов.
Жидкий абсорбент, пригодный для осушки природного газа, должен удовлетворять ряду требований, важнейшими из которых являются: I) высокое «сродство» по отношению к воде; 2) низкая стоимость; 3) некорро-зийность; 4) устойчивость к компонентам газа; 5) устойчивость во время регенерации; 6) простота регенерации;
7) низкая или средняя вязкость; 8) низкая упругость паров при температуре контакта; 9) низкая растворяющая способность по отношению к природному газу и углеводородным жидкостям и низкая растворимость в иих; 10) низкая склонность к образованию пены или эмульсий.
Всем этим требованиям в той или иной степени удовлетворяют два органических соединения: диэтиленгли-коль
*СН2 — СН2 — ОН
и триэтиленгликоль
сн2 — о — сн2 — сн2 — он, сн2 — о — сн2 — сн2 — он.
Эти два эфира многоатомных спиртов наиболее часто применяются для осушки природных газов путем абсорбции [XVI. 4 —XVI. 9, XVI. 20].
Прежде всего рассмотрим те физические свойства гликолей, которые составляют основу для технологических расчетов процессов осушки. Затем будет показано, какие из этих свойств необходимы при выборе режимов процесса.
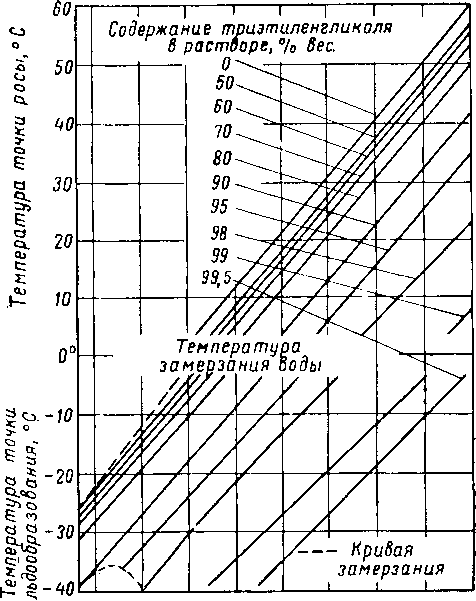
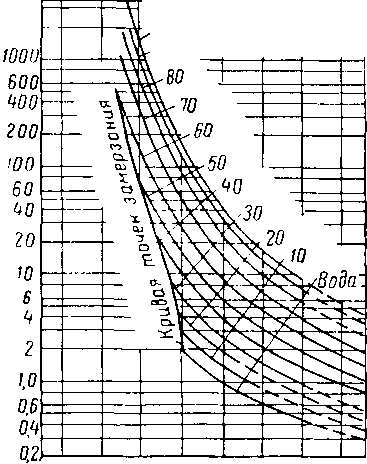
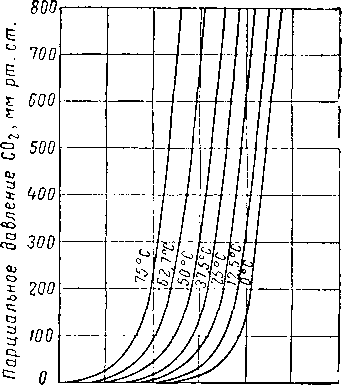
Вода и гликоли взаиморастворимы в жидкой фазе [XVI. 15]. Экспериментальные данные о равновесии пар — жидкость в водных растворах гликоля указывают на то, что упругость водяных паров в концентрированных растворах очень незначительна. Упругость паров воды, находящихся в равновесии с растворами гликоля различной концентрации, можно выразить при помощи кривых точек росы воды в зависимости от температуры раствора или контакта, поскольку выяснено, что точки росы относительно независимы от общего давления газа в системе. Такие кривые приведены на рис. XVI. 1 и XVI. 2 [XVI. 10]. Зная температуру контакта и концентрацию гликоля, можно легко определить температуру точки росы газа. Эти величины в сочетании с графиком водосодержания газа, приведенным на рис. V. 8, можно использовать для определения абсолютной влажности газа, находящегося в равновесии с гликолевыми растворами. Следует отметить, что, если гликоль не влияет на определение точки росы, точки замерзания, указанные ниже 0° С, могут представлять собой метастабиль-ные точки росы.
^ 50 5
«о
<г>
Си * Ц0 I 30
Is 20
<3 §¦
?
10
лоо
з
%-ю &
5:
сз
*•5
«а
%-зо & с S
-20
| / | ||||||||
| Содержание диэтиленгликоля В растворе, % вес |
А уЛ |
у | ||||||
| 4^ |
%/ Г/ | / | ||||||
| / | / |
|||||||
|
4 | V |
V / | / |
У | ||||
| /а | vy у / | / |
/V | У | ||||
| Гемпеоатиоа замерзания оооы | ||||||||
| / / / / // '/// | У |
У/ | / | |||||
| / // '/У/ | W У / |
•'z | v; |
у | ||||
| / у// | У/ |
/у | / | /у / / | Y | |||
| % | / | -- И за | р и Bl меры |
1 я ния | ||||
Температура контакта с раствором, °С
-20 -Ю 0° 10 20 30 40 50 60
Температура контакта с раст6ором,°С
Рис. XVI. 2. Влияние водных растворов триэтиленгли-коля на точку росы при различных температурах контакта [XVI. 10].
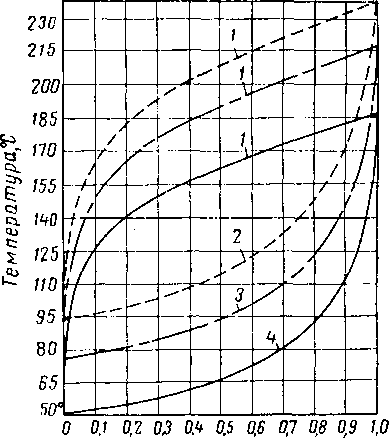
Хотя диэтиленгликоль и триэтиленгликоль обладают несколько более высокой вязкостью, чем другие абсорбенты, все же их вязкость при температурах не ниже 10° С, нельзя считать чрезмерно высокой. Влияние концентрации и температуры на вязкость водных растворов гликолей показано на рис. XVI. 3 и XVI. 4. Давление значительно влияет на вязкость ди- и триэтнленгликоля.
Влияние давления на вязкость в абсорбере частично компенсируется большим влиянием, оказываемым малорастворимыми газами, на вязкость жидкостей [XVI. 22]. По имеющимся данным вязкость диэтиленгликоля при давлении 70 кГ/см2 в 3—4 раза превышает соответствующий показатель при атмосферном давлении [XVI. 10]. Бриджмен (Bridgman) [XVI. 3] сообщает об аналогичном влиянии давления на вязкость соединений с сильно разветвленной молекулярной цепью. Вязкость и растворимость жидкой фазы являются основными переменными в корреляциях, определяющих общий к. п. д. тарелок в абсорберах.
Поскольку необходимо применять растворы с высокой концентрацией гликоля, регенерация разжиженных водных растворов гликоля не должна представлять трудности. Диаграммы изобарная температура — состав для системы гликоль — вода (рис. XVI. 5 и XVI. 6) и нормальная температура кипения водных растворов гликолей свидетельствуют о легкости, с которой можно повторно повышать концентрацию гликоля в этих растворах. Низкая концентрация воды в паровой фазе, находящейся в равновесии с 92—99%-ным весовым раство-
-60 -40 -20 0 20 40 60 80 93
Рис, XVI, 3. Вязкость водных растворов диэтилен гликоля [XVI. 13],
Мольная концентрации диэтиленгликоля
3000
2000
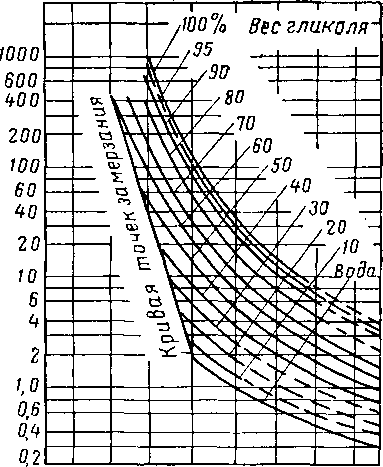
Рнс. XVI. 5. Кривые фазового состава для водных растворов диэтиленгликоля [XVI. 13].
1 — пар; 2 — жидкость при 600 мм рт. ст.; 3 — жидкость при 300 мм рт. ст.; 4— жидкость при 100 мм рт. ст.
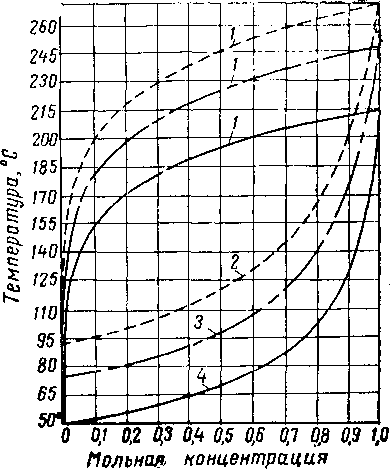
Рис. XVI. 6. Кривые фазового состава для водных растворов тризтиленгликоля [XVI. 13].
/ — пар; 2 — жидкость прн 600 мм рт. ст.\ 3 — жидкость при 300 мм рт. ст.\ 4 — жидкость при 100 мм рт. ст.
3000
7040
Т-I-1-г
¦100%6ес глиноля -90
тризтиленгликоля
¦60 - 40 -20 0 20 40 60 8093
Температура,°С
XVI. 4. Вязкость водных растворов три-этиленгликоля [XVI. 13].
ром гликоля, объясняется в основном низкой мольной концентрацией воды в этих растворах, а также тем обстоятельством, что коэффициент активности воды меньше единицы. Коэффициент активности при низких давлениях
РУ 1 : Рхг'
ti:
где fi — коэффициент активности воды; р — общее давление системы, представляющее собой сумму парциальных давлений воды и гликоля; у\ — мольная концентрация воды в газовой фазе; Р — упругость паров чистой воды; х{ — мольная концентрация воды в жидкой фазе.
Как сообщают Поллитцнер (Pollitzner) и другие [XVI. 9], потери триэтяленгликоля вследствие испарения составляют 0,16 л на 100 000 м3 газа, что согласуется с общей цифрой потерь гликоля, определенной в производственных условиях (0,33 л на 100 000 м3 газа) [XVI. 7], В последнюю цифру, помимо потерь от испарения, включены потери вследствие уноса, утечки, растворения и т. п.
Другим важным свойством гликолей является незначительная растворимость их в легких углеводородах. В связи с этим представляется возможной прямая ин-жекция диэтиленгликоля в двухфазные потоки, содержащие легкие углеводородные жидкости, С другой сторо-ны, легкие углеводороды (за исключением ароматических, — Ред.) в газообразном и жидком состояниях также очень мало растворимы в гликолях.
В присутствии легких углеводородов гликоли иногда склонны к пенообразованию. Однако при тщательном предварительном отбензинивании газа, поступающего в абсорберы, пенообразование доводится до минимума. Для уменьшения ценообразования с успехом были применены пеногасители [XVI, 7].
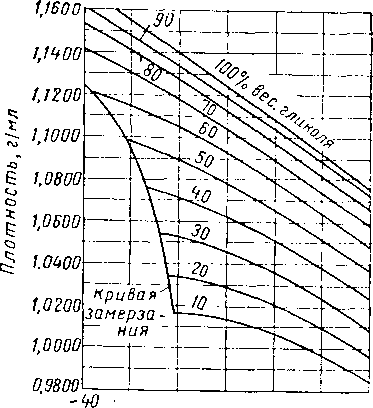
-20 0 20 W SD 80
Рис. XVI. 8. Плотность водных растворов триэтиленгликоля при различных температурах [XVI. 13].
Другие свойства водных растворов гликолей представлены в виде графиков на рис. XVI. 7—XVI. 15, Температура замерзания гликолевых растворов показана на рис. XVI, 14,
1,0100
1,0600
1,0500
1,0400
1,0300
1,0200
1,0100
1,0000
0,9900
0.9800
<ъ
S
с
с;
1,1500
1,1400
|
90 | ||||||||
|
1^" | ||||||||
|
Ъ- ° /9 | ||||||||
| \ | ¦> |
|||||||
| чХ |
— | |||||||
| 2п | ||||||||
|
крива | Я | N | ||||||
| замерзания |
||||||||
| 7~ГГТ | ||||||||
-Ч-0-30 -15 0° 15 30 Ь5 6 0 75 82
Температура, °С
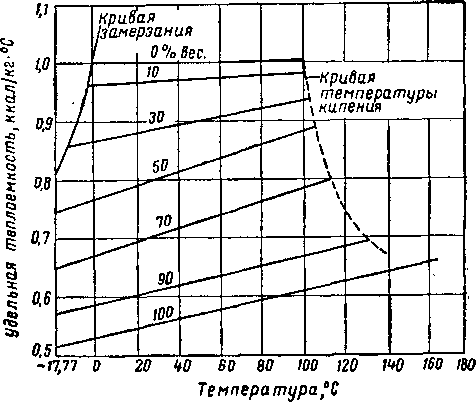
РйС, XVI. 9. Удельная теплоемкость водных растворов диэтиленгликоля [XVI. 13].
Рис. XVI. 10. Удельная теплоемкость водных растворов триэтиленгликоля [XVI. 13].
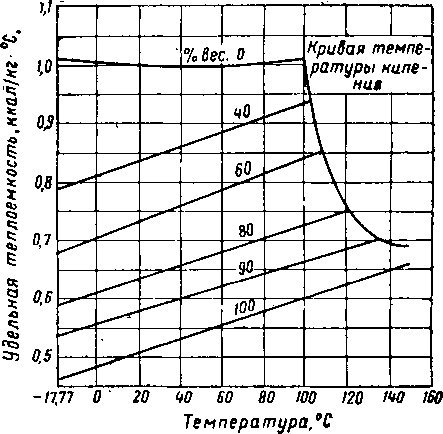
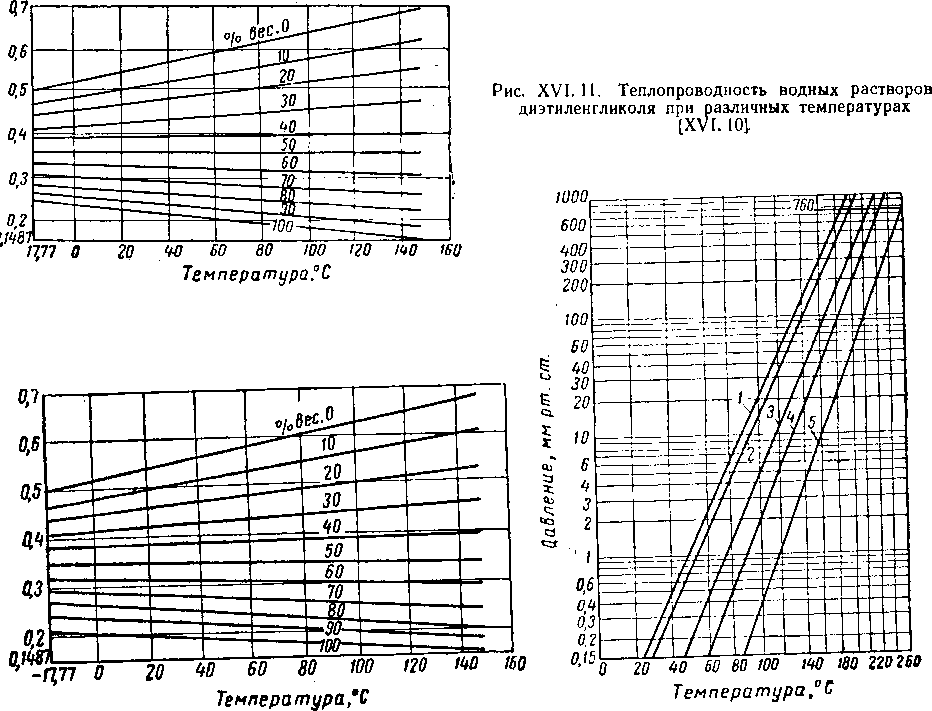
Рис. XVI. 13. Диаграмма Кокса для гликолей [XVI. 13].
/ — пропнленглнколь; 2 — этнленглнколь; 3 — ДИ* прогщленгликоль; 4 — днэтнленглнколь; 5 —• три* пропнленглнколь*
Теплопроводность, ннал!мч°с Теплопроводность, ккал/м. ч.°С
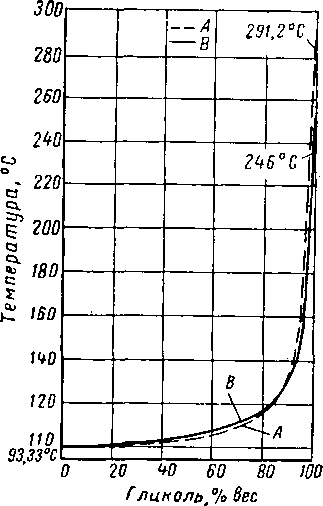
Рис. XVI. 14. Температура замерзания водных растворов ди- и три-этиленгликоля [XVI. 10, XVI. 13].
I —- триэтилеигликоль; 2 — дипропиленгликоль: 3 — диэтиленгликоль; 4 — про-пиленгликоль; 5 — этнленгликоль.
Гликоль, % вес,
5. ПАРАМЕТРЫ ПРОЦЕССА ОСУШКИ ГАЗА ГЛИКОЛЯМИ С ИСПОЛЬЗОВАНИЕМ ЦИКЛА АБСОРБЦИИ — ДЕСОРБЦИИ
В настоящее время диэтиленгликоль и триэтиленгли-коль находят широкое применение при осушке природного газа жидкими поглотителями. Типовые технологические схемы установок^ для осушки газа этими сорбентами представлены на рис. XVI. 16 и XVI. 17 [XVI. 7|
В основном обе установки имеют аналогичную конструкцию. Нужно отметить лишь различие в устройствах Для орошения.
п
I
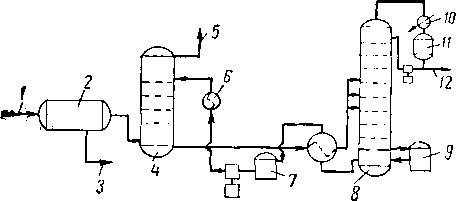
Рйс. XVI. 16. Технологическая схема установки осушки диэтиленгликолем [XVI. 7].
/ —| вход влажного газа; 2 — водоотбойник; 3 — сброс жидкости; 4 — абсорбер; 5 — выход сухого газа; 6 — холодильник гликоля; 7 — промежуточная емкость; 8 — выпарная колонна; 9 кипятильник-рибойлер; 10 — конденсатор орошения; 11 сборная емкость; 12 — сброс воды.
Абсорбер. Верхний предел температуры абсорбции определяется допускаемым уровнем потерь ди- и три-этиленгликоля от испарения, и практически верхний предел температуры составляет около 38° С. Фактическая температура абсорбции зависит от температуры, до которой можно охладить регенерированный гликоль, от температуры газа на входе в абсорбер, теплоты абсорбции воды и от соотношения между газом и жидкостью. Нижний предел температуры абсорбции усганавлива-
Рис. XVI. 15. Температура кипения водных растворов ди- и триэтиленгли-коля при атмосферном давлении [XVI. 13].
А — триэтилеигликоль; В — диэтилеигли-коль.
II
if4
-Ю
V-j,
из
•5 7
Рис. XVI. 17. Технологическая схема установки осушки триэтиленгликолем [XVI. 7].
/ — влажный газ из газопровода; 2— абсорбер; 3 — колпачковые тарелки; 4 — сухой газ в газопровод; 5 — регулятор уровня; 6 — гликоль с высоким содержанием воды; 7 — фильтр; 8 — промежуточная емкость; 9 — кипятильник-рибойлер (паровой илн прямого нагрева); 10—выпарная колонна; II — вода; 12 — насос; 13—ненасыщенный ГЛИКОЛЬ.
ется влиянием вязкости на влагопоглощающую способность при контакте.
Минимальная рабочая температура равна около 10° С, хотя установки с инжекцией гликоля рассчитаны на работу в условиях значительно более низких температур.
Давление, при котором должны работать гликолевые абсорберы, в значительно большей степени определяется экономическими соображениями (первоначальной стоимостью установок), чем равновесными фазовыми соотношениями. В литературе имеются данные о триэтиленгликолевых абсорберах, работающих при давлениях до 140 кГ/см2 [XVI. 7]. По-видимому, опубликованные ранее данные о том, что константа равновесия для воды в системе гликоль—-вода — природный газ повышается по мере увеличения давления, неверны [XVI. 19]. Это можно объяснить весьма высокими критическими давлениями систем природный газ — гликоль.
Площадь поперечного сечения абсорбера определяется в основном его пропускной способностью по газу, поскольку расход жидкости, необходимой для осушки газа, очень невелик. Можно применять обычные методы определения размеров колонн с колпачковыми тарелками, рассмотренные в главе XIV. Несмотря на низкий расход жидкости, к. п. д. отдельных тарелок в правильно рассчитанной колонне может доходить до 70%.
Точка росы воды для газа, выходящего из абсорбера, определяется степенью регенерации и охлаждения гликолевого раствора. Можно добиться снижения точки росы примерно на 28° С, что соответствует 95— 96%-ной (по весу) концентрации раствора диэтилен-гликоля, поступающего в абсорбер. В свою очередь это соответствует максимальной температуре регенерации 165° С. Триэтиленгликоль позволяет снизить точку росы на 33—42° С, что соответствует регенерированным растворам, содержащим 98—99% (по весу) гликоля.
Выпарная колонна. Важным параметром ее работы является температура, поскольку ею определяется концентрация регенерированного абсорбента, а излишне высокая температура вызывает термическое разложение гликоля. Максимальная температура в регенераторе, допускаемая для водных растворов диэтиленгликоля, составляет 165° С, хотя иногда можно допустить повышение температуры до 175° С. Разложению гликолей соответствуют кислород и сероводород, вследствие чего их присутствие требует снижения температуры регенерации по сравнению с нормальным уровнем. Были высказаны рекомендации об удалении растворенных газов путем снижения давления отработанного гликоля, выходящего из абсорбера [XVI. 23].
Для десорбции тризтиленгликоля требуется еще меньшее орошение. В небольших установках достаточное орошение можно получить при использовании вертикальной трубы с развитой поверхностью, охлаждаемой непосредственно атмосферным воздухом.
Контакт между газом и жидкостью в десорбере обеспечивается при помощи колпачковых тарелок в больших колоннах и насадки в колоннах меньшего размера. Для разделения требуется небольшое число теоретических тарелок, тем не менее предусматривается большой запас тарелок или насадки.
Вспомогательное оборудование установок осушки гликолем включает насосы, теплообменники, кипятильники, рибойлеры, фильтры и т. п. Это оборудование обстоятельно описано в специальных статьях [XVI. 7,
XVI. 20],
Твердые поглотители (или адсорбенты) широко применяются для осушки газов. В последнее время твердые поглотители стали использовать и для удаления воды из жидкостей. Адсорбенты имеют свойство поглощать воду из углеводородного потока и отдавать ее другому потоку с Оолее высокой температурой во время регенерации.
Прежде в литературе было принято классифицировать адсорбцию на химическую или физическую в зависимости от того, какой характер (физический или химический) имеет взаимодействие между поглощенными молекулами и твердой поверхностью. В настоящее время суть адсорбции объясняется силами, привлекающими молекулы к поверхности твердых тел. Привлечение воды к осушителям вызывается действием сил Ван дер Ваальса или сил, обязанных своим возникновением «эффекту дисперсии» [XVI. 17], который можно отнести к физической категории. Равновесие между твердой и газообразной фазами при адсорбции за счет сил Ван дер Ваальса является обратимым и быстро изменяется в соответствии с изменившимися условиями температуры и давления.
Для адсорбентов характерна исключительно большая площадь поверхности, объясняющаяся наличием большого числа мелких неоднородных по форме капилляров. Поверхность этих капилляров представляет собой большое поле действия остаточных сил. Единственно возможным путем, который может свести остаточные силы к минимуму, является конденсация иа данной поверхности. Конденсация происходит в мелких капиллярах, причем образуются не капельки жидкости, а множество мелких выпуклых ее поверхностей. Термодинамические расчеты показывают, что упругость паров жидкостей, находящихся в мелких увлажненных капиллярах, значительно меньше, чем упругость паров плоской поверхности той же жидкости [XVI. 6]. Следовательно, упругость паров жидкостей в этих капилля» рах равновесна парциальному давлению паров воды, которое значительно меньше нормального давления насыщения. Другой интересной характеристикой, показывающей высокую степень капиллярности, является то, что количество адсорбированного вещества, находящееся в равновесии с газом данного парциального давления, зависит от направления достижения равновесия. Это явлеиие, известное под названием «гистерезис адсорбции» [XVI. II] при промышленном применении процесса осушки газа твердым поглотителем, очевидно, теряет свое значение уже после несколькнх циклов адсорбции — регенерации.
Изменение температуры и другие факторы, вызывающие разрушение физической структуры адсорбента, уменьшают его способность поглощать и удерживать воду. Кемпбелл, Скиннер и Лоуренс (Kampbell, Skinner and Laurence) [XVI. 5] приводят следующие требования, которым должен удовлетворять хороший зернистый поглотитель: I) высокая равновесная адсорбционная емкость по отношению к воде; 2) обратимость адсорбции и простота регенерации; 3) высокая скорость адсорбции; 4) малое сопротивление потоку газа; 5) высокая механическая прочность, предотвращающая дробление и распыление поглотителя; 6) химическая инертность; 7) небольшие объемные изменения в зависимости от температуры и степени насыщения.
В настоящее время разработаны и непрерывно совершенствуются поглотители, удовлетворяющие всем этим требованиям. Наиболее часто применяемыми адсорбентами являются боксит, активированная окись алюминия и силикагель, которые выпускаются различными фирмами под различными иаимеиованиями.
Ниже рассматриваются равновесные, кинетические, химические и механические качества некоторых наиболее экономичных поглотителей.
Поскольку осушку газов и жидкостей адсорбцией производят с использованием неподвижного слоя твердого адсорбента, этот процесс является периодическим. Однако поскольку приближение к равновесным условиям между потоком газа и слоем адсорбента может быть очень близким, знание равновесных соотношений необходимо для определения практически целесообразной предельной пропускной способности слоя адсорбента [XVI. 14].
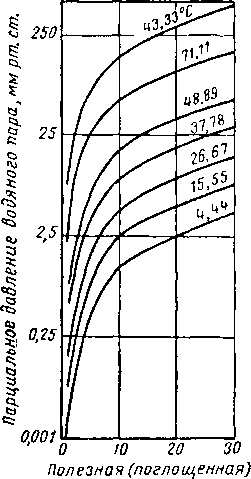
На рис. XVI. 18 представлены типовые изотермы равновесной адсорбции, показывающие взаимозависимость между парциальным давлением паров воды в газе и поглощенным количеством воды, выраженным в процентах к весу регенерированного (активированного) адсорбента [XVI. 18]. Зависимость равновесных условий от температуры очевидна.
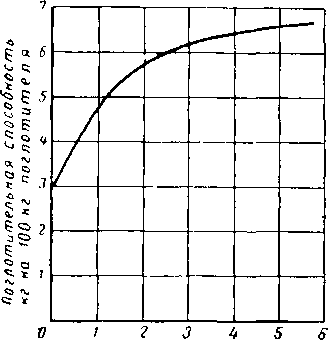
Поглотительная способность промышленных адсорбентов по мере их использования уменьшается, поскольку: I) некоторые из наиболее эффективных адсорбентов необратимо теряют активность и 2) поглощенные углеводороды высокого молекулярного веса могут с трудом поддаваться, десорбции. Уменьшение активности промышленного поглотителя, регенерируемого через каждые 16 ч, показано на рис. XVI. 19 [XVI. 16]. Очевидно, что в качестве расчетной поглотительной способности адсорбента следует брать величину, несколько меньшую, чем «асимптотическая величина» на кривой поглотительной способности. Полезная поглотительная способность слоя адсорбента зависит от скорости газового потока, которая часто выражается временем контакта. Рис. XVI. 20 показывает, что поглотительная способность при рационально коротком времени контакта может не зависеть от расхода газа [XVI. 2]. Данные получены в колонне диаметром 915 мм, заполненной бокситом, зерна которого имели размеры 2,8 мм, активированным при 177° С. В большинстве случаев достаточное время контакта обеспечивается при линейной скорости газа менее
0,3 м/сек.
время контакта, сен
Рис. XVI. 20. Влияние времени контакта на поглотительную способность боксита (флорита) [XVI. 2],
со
• 5с <5 О
? а О t
1:
ъ?0
с;
|/5
Е Ю о
5 5
о
с
Е
a
is*
cu О о с: м С; о *
о г ч- 6 в to n ik 16 18
Продолжительность использованияtмес.
Рис. XVI. 19. Влияние продолжительности использования активированной окиси алюминия Н-151 на ее поглотительную способность [XVI. 16].
| 1 / 1 1 Активированный _ глинозем | ||||||||
|
- | ||||||||
влажность силикагеля Vo dec. регенерирован ного поглотителя
Рис. XVI. 18. Изотермы адсорбции воды на силикагеле.
Рис. XVI. 21. Типовая кривая «проскока», показывающая соотношение влажности на выходе и входе как функцию времени.
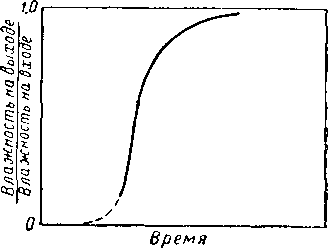
Иглтон и Блисс (Eagleton and Bliss) изучали степень осушки воздуха в неподвижных слоях активированной окиси алюминия, боксита н силикагеля [XVI. 14]. Влажность воздуха на выходе из адсорбера измерялась при различных величинах начальной влажности, температуры и расхода воздуха, высоты слоя адсорбента. Исследования Иглтона и Блисса позволяют сделать вывод, что степень осушки определяется диффузией как через пленку воздуха, так и внутри твердой частицы. Типовая кривая «проскока», показывающая соотношение .между влажностью воздуха на выходе из адсорбера и влажностью воздуха на входе как функцию времени, приведена на рис. XVI. 21. Для промышленного адсорбера ширина кривой «проскока» достаточно мала, так что для осушки газа можно использовать, по-видимому, около 95% высоты слоя адсорбента.
На рис. XVI. 22 показано распределение воды в слое адсорбента и в потоке газа в начале периода осушки, после истечения 30% времени осушки и в конце ее перед «проскоком». Чтобы обеспечить максимальную эффективность регенерации, регенерационный период десорбции нужно начинать непосредственно перед тем, как из слоя адсорбента начнет выходить («проскакивать») неосушенный газ. Кривая «проскока» на рис. XVI. 21 показывает профиль кривой перепада влажности в той части слоя, которая не полностью насыщена водой.
И РЕГЕНЕРАЦИЯ ТВЕРДОГО ПОГЛОТИТЕЛЯ
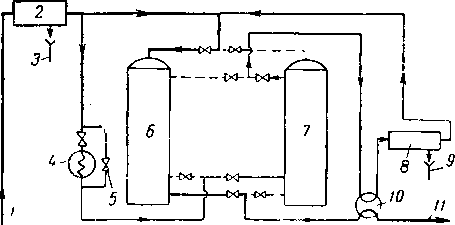
Поглощение углеводородов адсорбентами происходит вследствие действия тех же сил, которые вызывают поглощение воды. Та часть сорбента, которая в данное время не осуществляет осушку газа, поглощает углеводороды, преимущественно тяжелые. Когда осушка прекращается непосредственно перед моментом «проскока», в той части слоя, которая не была использована для осушки, будут находиться поглощенные углеводороды. В конденсате, отводимом из адсорберов во время регенерации, часто содержатся жидкие углеводороды. В некоторых случаях твердые поглотители можно использовать для осушки газа и удаления из газа тяжелых углеводородов перед подачей его в трубопровод. В процессе регенерации твердого поглотителя «Совабид», использовавшегося для осушки газа, при температуре 15,6° С и давлении 49 кГ/см2 получали 0,17—0,21 л газового бензина на 1 кг сорбента. Сил (Seale) сообщает [XVI. 24], что при адсорбции пол давлением 56 кГ/см2 на 100 кг адсорбента извлекалось 25 л углеводородов. При переработке газа в количестве 651 300 м3/сутки при 72-минутном цикле адсорбции — регенерации на установке получали в сутки 3,7 м3 углеводородов и 0,320 м3 воды. Регенерацию твердого поглотителя в большом промышленном адсорбере обычно производят путем пропускания через него природного газа, нагретого до температуры 175—230° С (рис. XVI. 23). Более высокая температура регенерации
ot с:
sg « й
Вода 'g В газеъ
Рис. XVI. 23. Технологическая схема осушки твердым поглотителем.
/ — влажный газ; 2 — водоотбойник; 3 — вода; 4 — нагреватель; 5 —обводная линия для охлаждения; 6 — адсорбционная колонна; 7—регенерационная колонна; 8—сепаратор; 9 — вода н углеводороды; 10 — теплообменник; // — сухой газ.
уменьшает срок службы твердого поглотителя, а менее высокая приводит к снижению поглотительной способности адсорбента.
Рис. XVI. 22. Типовые кривые перепада влажности в поглотителе и в газовой фазе в период адсорбции.
сз
* -о
jh CCS О
rf1
¦о ^
Й2-53 ^ Vj С; w-сэ
бода в поглотителе
I 3
С5 З-» * 5:'О
й ч>
1Й
^ ' СЭ
«о
’Ь.
Сопротивление, оказываемое слоем зернистого поглотителя потоку газов и жидкостей, было изучено Алленом (Allen) [XVI. 1], а также Аме-ро (Ат-то) и другими [XVI.2]. Кривая, полученная Амеро, воспроизводится на
рис. XVI. 24. Для пересчета размера частиц в мешах в мм можно воспользоваться табл, XVI. 1.
| Размер частиц | Средний диаметр |
| в мешах | частиц в мм |
|
ги | 3,96 |
| 1ы |
2,77 |
|
8/и | 1,12 |
Таблица XVI. 1
Пересчет размера частиц твердого адсорбента в мешах в показатели среднего диаметра частиц [XVI. 2]
Рис. XVI. 24, Перепад давления по слою зернистого поглотителя [XVI. 2],
fG'iL Ар = 0,029-1 0
где Др —перепад давления по слою в кГ/см2; ?>р—средний диаметр частицы в и; g — ускорение, вызванное силой тяжести, 9,8 м/сек2', Ош — поверхностная массовая
кг/мг ¦ сек; L — толщина слоя адсорбента в м\ /—коэффициент трения; р — средняя плотность потока в кг/м s
скорость
Не все твердые поглотители имеют одинаковый коэффициент шероховатости, но по коэффициенту трения различные поглотители лишь незначительно отличаются друг от друга [XVI. 5]. Перепад давления для газа удельного веса 0,677 при использовании адсорбентов двух размеров показан на рис. XVI. 25 [XVI. 2].
В вертикальных колоннах для предотвращения подъема поглотителя при колебании давления в системе принято пропускать газ сверху вниз.
о.з o,i о,5 а? ол
5 ( 7 8 9’Г,
Перепад двВденшм, м» SoB cmjr>n слов насад*и
Рис. XVI. 25. Перепад давления через слой адсорбента для газа удельного веса 0,677 [XVI. 2].
Чтобы сохранить водопоглотительную способность, адсорбент должен быть химически инертным по отношению к компонентам природного газа. Во избежание смещений слоя адсорбента после загрузки его в адсорбер изменение объема поглотителя при изменении температуры и степени осушения должно быть небольшим.
Периодические расширение и сжатие способствуют растрескиванию частиц поглотителя. Поглотитель заменяют через каждые 2—5 лет. При осаждении масел или посторонних примесей у входа в колонну поглотитель заменяют чаще.
3. ПАРАМЕТРЫ ПРОЦЕССА ОСУШКИ ТВЕРДЫМ ПОГЛОТИТЕЛЕМ
Параметры процесса, учитываемые при расчете установок осушки газа твердым поглотителем, определяются рассмотренными выше свойствами поглотителей и экономическими соображениями.
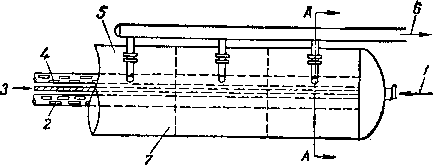
Там, где экономия производственных площадей не имеет решающего значения, лучше применять горизонтальные адсорберы с поперечным движением газа вокруг перегородки (рис. XVI. 26) [XVI. 7], Таким образом уменьшается перепад давления по слою и обеспечивается большая маневренность благодаря размещению адсорбента в отдельных отсеках, которые можно изолировать друг от друга. При расчете промышленных адсорберов применяют асимптотическую величину водопоглотительной способности в 5—7%, хотя имеются сообщения о разработке нового адсорбента, способного поглощать 12% (по весу) воды [XVI. 16].
При использовании в качестве поглотителя активированной окиси алюминия в тех случаях, когда температура контакта превышает 32° С, величину водопоглотительной способности необходимо несколько скорректировать, Температура на входе в абсорбер бывает на 1—3° С выше температуры основного газового потока вследствие повторной подачи газа, который был ранее использован для регенерации адсорбента. Это и следует ожидать, поскольку для регенерации используют 5—15% общего количества обрабатываемо
Рис. XVI. 26. Схема горизонтального адсорбера [XVI. 71.
*
=3 У * ° II
о "
ё 2 а *
3-
с
5
го АА
/ — вход газа; 2 — коллектор для входящего газа; 3 — перегородка; 4 — коллектор для выходящего газа; 5 --фланцы с отверстиями; 6 — выход газа;
7 — перегородки камер; 8 — газ в коллектор; 9 —люки для засыпки поглотителя; fO — отверстие для спуска жидкости из поглотителя. Внутренние коллекторы покрыты сплавом (монель-ме-таллом); адсорбер полностью заполнен поглотителем.
го газа. Примерно 35/з тепла расходуется на нагрев адсорбера и находящегося в нем поглотителя. Типичная кривая температуры во время цикла регенерации приведена на рис. XVI. 27. Если для регенерации используется нагретый природный газ, тепловая нагрузка складывается из следующих элементов: 1) теплосодержания адсорбера и твердого поглотителя; 2) теплосодержания регенерационного газа; 3) теплоты десорбции воды; 4) потери теплоты в окружающую среду.
Во время цикла нагрева, если в качестве регенерационного агента используется природный газ, скорость теплопередачи
Т 1MVCPV (r2 - Тх) + MdCpd (Г2 - тх) +
t
+ MAcPg)(T
¦ г,) + Mw ДН + потери тепла],
(XVI. 2)
220
180
140
100
60
|
Вход | |||||||
| шф- |
|||||||
| / | |||||||
|
/ | |||||||
| / |
\ | ||||||
| / |
Bxo/h- | ||||||
|
РеактиОаии^ Десоц^ |
\oyfo | Охл'амде-нце ' | |||||
о г и 6 8
Рис. XVI. 27. Кривая температуры во время цикла регенерации.
где Q/t — скорость теплопередачи в ккал/ч; t — продолжительность цикла нагрева в ч\ М„ — масса адсорбера в кг\ Cpv — удельная теплоемкость материала, из которого изготовлен адсорбер, в ккал/кг-°С; Тг — температура адсорбера при условии регенерации в °С; Т\ — температура адсорбера в начале цикла в °С; Md — масса поглотителя в кг\ CPd—удельная теплоемкость поглотителя в ккал/кг ¦ °С; Mg — масса газа, используемого в нагревательный период регенерационного цикла, в кг; CPg — удельная теплоемкость природного газа в ккал/кг • °С; Mw — масса воды, поглощенной во время цикла, в кг; 4 Н — теплота десорбции воды, равная 610 ккал/кг. Потери тепла равны общей сумме потерь тепла во время цикла регенерации в ккал.
Для изолированных адсорберов потери тепла не должны превышать 10% тепла, требуемого для адиабатического процесса.
При определении размеров сепараторов и теплообменников, показанных на рис. XVI. 23, важно учесть то обстоятельство, что большая часть воды десорбируется примерно за один первый час, а не равномерно в течение всего нагревательного периода регенерационного цикла. Средняя температура газа на выходе из регенератора равна 121° С, что несколько ниже максимальной температуры регенерации.
Обезвоживание жидкостей обусловливается теми же причинами, которые обусловливают осушку газов. Однако техника промышленного обезвоживания жидкостей достаточно отлична от техники осушки газов и заслуживает специального рассмотрения. Для обезвоживания жидких легких углеводородов чаще всего применяют адсорбцию и фракционную перегонку. Переменное водосодержание легких углеводородных продуктов обусловливает особенно широкое применение адсорбционного метода осушки.
1. ПРОЦЕССЫ АДСОРБЦИОННОЙ ОСУШКИ
Кемпбелл и Лоуренс (Campbell and Laurence) [XVI. 6] различают четыре метода адсорбционной осушки, отличающиеся друг от друга способом регенерации отработанного поглотителя;
1)у закрытые системы с применением парообразного продукта;
2) закрытие системы с применением водяного пара;
3) открытые системы с применением парообразного продукта;
4) открытые системы с применением водяного пара.
Закрытыми называются системы, в которых нагревающий агент не находится в црямом контакте с адсорбентом. Во время регенерации жидкие продукты, удерживаемые ¦ частицами поглотителя после выпуска жидких углеводородов из его слоя, образуют главный источник регенерационного газа. В открытых системах источником тепла является либо перегретый водяной пар, либо, что предпочтительнее, горячие газы, находящиеся в непосредственном контакте со слоем поглотителя.
Предварительным условием любого процесса осушки является удаление свободной воды. Но даже самый эффективный сепаратор не может обеспечить удаление всей свободной воды из углеводородной жидкости. В среднем 20% общего влагосодержания составляет свободная вода.
При подготовке жидких легких углеводородов к транспортировке по продуктопроводу принято снижать влажность до величины, меньшей, чем концентрация насыщения при самой низкой температуре в магистрали. По техническим условиям для пропана, принимаемого для транспортировки по трубопроводу, предусматривается обычно содержание не более 17—30 частей воды на тысячу.
Количество адсорбента, необходимого для данной установки, определяется его поглотительной способностью в присутствии легких углеводородов; адсорбент должен обеспечить полное удаление воды из сырья. Целесообразнее всего определить влажность сырья на основе результатов измерения, Исходной величиной может служить содержание воды в легких углеводородах в условиях насыщения, взятое по рис. V. 18 или V. 19, умноженное на коэффициент 1,25 с целью учета содержания свободной воды. Это и есть расчетная влажность сырья, выходящего из водоотбойпого сепаратора, Время контакта равно 2—3 мин, хотя при лабораторных испытаниях для обезвоживания бензина достаточным оказалось время контакта в 3 сек [XVI. 12],
2. ОБЕЗВОЖИВАНИЕ ЖИДКОСТЕЙ ПЕРЕГОНКОЙ
Системы жидкость—жидкий газ, обнаруживающие ограниченную смешиваемость с водой, можно осушить перегонкой при условии, что концентрация воды в загрузочном сырье меньше концентрации водонасыщения легкого углеводорода или близка к ней. Например, перегонка, проведенная в интервале L2—V (рис. V. 1), приведет к осушке углеводородной жидкой фазы и к переводу воды в парообразную фазу. Схема обезвоживающей фракционирующей колонны, в которой вода выводится с верхним продуктом, а нижним продуктом являются обезвоженные углеводороды, показана на рис. XVI. 28. Для расчета числа теоретических тарелок, необходимого для осуществления желательной осушки, можно воспользоваться вычисленными или экспериментально установленными величинами констант равновесия
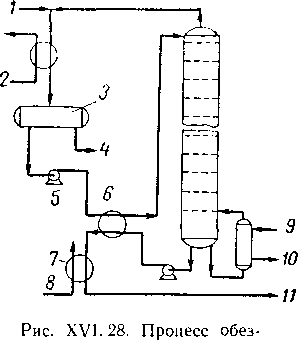
воживания жидких углеводородов перегонкой [V, 30].
1 — парообразный влажный
углеводород; 2 — вода; ,3 — отстойник для влажного углеводорода; 4 — спуск воды; 5 — влажный углеводород нз отстойника; 6 — теплообменник;
7 — холодильник; 8 — охлаждающая вода; 9 — подача пара;
10— выход конденсата; 11 — обезвоженный жидкий углеводород.
для воды в легких углеводородах. Однако рациональность применения концепции теоретической тарелки уменьшается тем обстоятельством [V. 30], что общая эффективность тарелки в данном случае будет порядка 4—8%, Число теоретических тарелок может составить
1 или 2, в то время как в действительности колонна должна будет иметь до 30 тарелок.
Перегонка сводится по существу к выпариванию, поскольку подача сырья осуществляется у самого верха колонны. Джестер (Gester) [V, 30] сообщил, что при осушке гексанов коэффициент десорбции составляет
0,16—0,24 кг поднимающегося пара на 1 кг опускающейся жидкости.
§ 4. ЭКОНОМИЧЕСКИЕ ПОКАЗАТЕЛИ ОСУШКИ ПРИРОДНОГО ГАЗА
Экономичность того или иного метода осушки природного газа лучше всего можно определить калькуляцией первоначальных и эксплуатационных расходов для соответствующей установки. Наиболее выгодной с точки зрения первоначальной стЬимости и эксплуатационных затрат является осушка гликолем [XVI. 8] (рис. XVI. 29 и XVI. 30). По данным Кемпбелла в 1952 г. эксплуатационные расходы при осушке триэтиленгликолем составляли от 7 до 14 долл., а при осушке твердым поглотителем— от 21 до 42 долл. на 1 млн. м3 газа. Тем не менее, несмотря на более высокую стоимость, вследствие простоты эксплуатации часто выбирают установки с твердым поглотителем (особенно при больших колебаниях влажности и расхода газа). Важными факторами
![]()
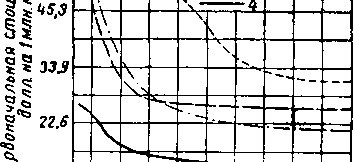
^ tl327'—t------ХП
0,0566 0,424 0,707 0.849 1,27
Пропускная способность установки, млн. м3/суткц
являются гибкость установок в работе и обеспечение неизменно полного удаления жидкостей из обрабатываемого газа.
Если нужно довести влажность до очень небольшой величины (в частности, для тех процессов, которые идут при температурах ниже —45°С), всегда применяют твердые поглотители, по крайней мере для последней ступени обезвоживания. Для одновременного удаления из газа, выходящего из скважины, воды и жидких углеводородов в условиях небольшого перепада давления требуется инжекция гликоля. Осушать газы при пвмощи твердых поглотителей можно при более высоких температурах, чем жидкие.
5«
а-^ g
| U3
О! 5
§ 13 S •3§§
с> й.%
S' о;
cgcg
1,1
Рис. XVI. 30. Зависимость первоначальной стоимости установок газоосушки от рабочего давления [XVI. 8].
1 — твердый поглотитель; 2 — гликоль.
|
\ | ||||||||
|
¦'2 | ||||||||
| / |
||||||||
| / / J |
V | |||||||
| ? | ||||||||
| ” - |
||||||||
§ 5. ОЧИСТКА ПРИРОДНОГО ГАЗА ОТ СЕРОВОДОРОДА И УГЛЕКИСЛОТЫ
Во многих природных газах содержится сероводород H2S от едва уловимого количества до 30% мол. и более. Природный газ, предназначенный для поставки потребителям, должен соответствовать обязательным стандартам, которые обусловливают максимальное содержание H2S в количестве 0,23—0,58 г на 100 м3, Столь жесткие требования вполне оправданы, поскольку H2S является ядовитым газом, а при его сгорании образуются двуокись S02 или триокись S03 серы.
Удаление сероводорода из природного газа сопровождается удалением двуокиси углерода (если таковая содержится в газе), поскольку С02 по своему кислотному характеру сходен с H2S. Удаление из поступающего в трубопровод газа H2S и С02 значительно снижает его коррозийность, что особенно важно при возможности образования в трубопроводе конденсата воды.
бента применяются водные растворы органических аминов [XVI. 29, XVI. 43, XVI. 58]. Имеются варианты процесса «Гирботол», обеспечивающие одновременное удаление воды и сероводорода из газа [XVI. 32], а также избирательное поглощение H2S из газов, содержащих углекислоту [XVI.40].
В других процессах с регенерацией применяются следующие поглотители: 1) вода; 2) водный раствор углекислого натрия (процесс «Сиборд») [XVI. 64]; 3) сухая окись железа [XVI. 62]; 4) водный раствор тиомышья-ковокислого натрия или аммония (процесс «Тайлокс») [XVI. 53]; 5) водный раствор трехзамещенного фосфорнокислого калия (процесс Шелл) [XVI. 45]; 6) водный раствор фенолата натрия [XVI. 63]; 7) водный раствор углекислого натрия и окиси железа [XVI.45]; 8) горячий водный раствор углекислого натрия [XVI. 27].
1. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ПРОЦЕССУ ОЧИСТКИ ГАЗА
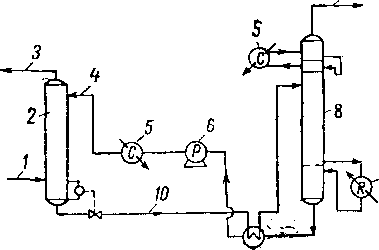
Рис. XVI. 31. Технологическая схема очистки газа от H2S и С02 раствором амина.
1 — газ. содержащий Н 2S и СОа: 2— абсорбер; 3 — очищенный газ; 4 — ненасыщенный раствор амина; 5 — компрессор; 6 — насос; 7 — расширительная машина; 8 — регенератор; 9 —кислый газ; 10 — богатый раствор амина.
Процесс очистки газа, экономически пригодный для газовой промышленности, должен обеспечивать: 1) практически полное удаление H2S; 2) обработку больших количеств газа; 3) проведение очистки при высоком давлении.
Имеется много процессов, которые могут удовлетворить этим требованиям. Некоторые из этих процессов с успехом применялись в химической и газоперерабатывающей промышленности и были усовершенствованы в последнее время. Их можно разделить на процессы с регенерацией и без регенерации поглотителей.
Процессы, не обеспечивающие возможность регенерации поглотителей, нельзя применять для удаления больших количеств кислых газов. В определенных условиях процессы без регенерации поглотителя, как, например, очистку известковым молоком (взвесью Са (ОН)г, абсорбцию раствором каустической соды, марганцовокислого калия или буферным раствором двухромовокислого натрия и сернокислого цинка, можно применять для тонкой очистки газа от H2S после грубой иными методами. При помощи этих процессов снижается содержание H2S до уровня, недостижимого при использовании процессов с регенерацией.
Среди процессов с регенерацией, используемых для удаления кислых газов, необходимо назвать прежде всего процесс «Гирботол», в котором в качестве абсор-
БблЬШйя часть этих Процессов Не Выдержинйет конкуренции с процессом «Гирботол», за исключением специальных случаев очистки. Горячий водный раствор углекислого натрия имеет некоторые преимущества при обработке природного газа с очень высоким содержанием кислых газов. Весьма экономичным обещает стать новый процесс, основанный на реакции SO2 C .H2S в присутствии гликолевого раствора с образованием элементарной серы [XVI. 58а].
Хотя этот раздел будет посвящен в основном очистке природного газа от сероводорода при помощи водных растворов органических аминов, кратко изложенные общие теоретические данные об одновременной абсорбции и химической реакции относятся и ко многим другим перечисленным выше процессам. Один из вариантов очистки природного газа от сероводорода раствором амина показан на рис. XVI. 31,
2. КОНСТАНТЫ РАВНОВЕСИЯ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДНЫХ РАСТВОРОВ АМИНА
Системы, образуемые кислыми газами с водными растворами этаноламинов, по своему фазовому поведению и кинетическим качествам обеспечивают почти полное отделение кислых газов от инертных в многоступенчатых контактных колоннах. Фазовое распределение кислых газов в водных растворах амина таково, что эти растворы имеют высокую способность поглощать кислые газы вследствие химических реакций, создавая в тоже время очень низкое равновесное давление паров. Другое требование, которому также удовлетворяют аминовые растворы, состоит в обратимости равновесия между фазами при более высокой температуре, что позволяет регенерировать и повторно использовать раствор.
Органические этаноламины представляют класс органических соединений, который можно применять для практически полного удаления H2S и СО2 из «инертных газов», как, например, природных газов. В табл. XVI. 2 приведены физические свойства, а в табл. XVI. 3 [XVI. 30] химические формулы и некоторые физические константы моно-, дн- и триэтаноламина—трех аминов, которые применяют в настоящее рремя. Табл. XVI. 3 представляет собой сводку имеющихся в литературе данных о равновесной упругости паров кислых газов в различных системах, состоящих из кислых газов, органических
| Наименование | МЭА* |
ДЭА** | ТЭА*** |
| Молекулярный вес . . . |
61,08 | 105,14 |
149,19 |
| Кажущийся удельный вес | |||
| при 20° С...... |
1,0179 | 1,0919 |
1,1258 |
| Удельный вес/Д Т . . . | 0,00078 |
0,00064 | 0,00054 |
| Температура кипения, °С: | Разла | 358 | |
|
при 760 мм pm. cm. |
171 | ||
|
гается | |||
| » 50 » » » | 100 |
187 | 244 |
|
» 10» » » | 69 |
150 | 208 |
|
Упругость паров при | 0,01 | ||
|
20° С, мм pm. cm. . . |
0,4 | 0,01 | |
| Температура замерзания, |
21,2 | ||
| °С.......... | 10,5 | 28,0 | |
|
Растворимость при 20° С, | |||
| % вес: |
|||
| в Н20....... | Полная | 96,4 | Полная |
| Н20 в амине .... | » | 96,4 |
» |
| Абсолютная вязкость при | |||
| 20° С, спз...... |
24,1 | 380 |
1013 |
| Показатель преломления |
1,4852 | ||
| при 20° С...... | 1,4544 |
1,4747 | |
| Теплота испарения, | |||
| ккал/кг ....... |
197 | 158 |
128 |
• МЭА — моноэтаноламин,
** ДЭА — днэтаноламин.
*** ТЭА — триэтаноламин.
аминов и аоды. Эти данные относятся в основном к системам углекислота — амин, хотя некоторые данные относятся и к системам, содержащим H2S. Достаточно взглянуть на таблицу, чтобы убедиться в недостатке данных о равновесиях систем кислый газ— водный раствор амина при высоких температурах. Этот недостаток равновесных и термодинамических данных и показателей, характеризующих скорость протекающих процессов, создает большие затруднения при расчетах, связанных с десорбцией (регенерацией) раствора. Данные Риттера и других о растворимости H2S в водных растворах моноэтаноламина при различных уровнях парциального давления, температуры и мольной кон-
Даиные о растворимости кислых газов в
Таблица XVI. 3 аминах при равновесии и их источники
| Система* |
Интервал темпе ратур, •С | Интервал парциального давления кислого газа | Литера тура |
| СО, — ДЭА — Н20................... |
25—55 | 0—760 мм pm. cm. | XVI.29 |
|
С02 — ТЭА — Н20................... |
25—55 | 0—760 » » » |
XVI.29 |
|
С02—МЭА—Н20................... | 0—75 | 1—760 » » » | XVI.52 |
|
С02—ДЭА —Н20................... |
0—75 | 10—760 » » » |
XVI.52 |
| С02 — ТЭА — Н20................... |
0—75 | 1—760 » » » | XVI.52 |
|
С02—МЭА —Н20................... |
25—60 | 25—700 » » » |
XVI.59 |
|
С02—МЭА —Н20................... |
25—75 | 2,5—41 am | XVI.51 |
|
С02 — ДЭА — Н20................... |
25—75 | 2,5—41 » |
XVI.51 |
| С02 — H2S — МЭА — Н20................ | 15—50 | 0,050—66 мм pm. cm. | XVI.48 |
| С02 — H2S — ДЭА—Н20 ................ |
15—50 | 0,30—312 » » » | XVI.48 |
|
С02—МЭА...................... |
25—70 | 2—42 am |
XVI.26 |
|
С02—МЭА....................... |
60—140 | 2—42 » |
XVI.41 |
| С02 — МЭА....................... | 100—140 | 1,5—15 » | XVI.37 |
| С02 —H2S —МЭА ................... | 25—100 |
0—1 » | XVI.52a |
* МЭА — моноэтаноламин; ДЭА — диэганоламип; ТЭА— триэтаноламин.
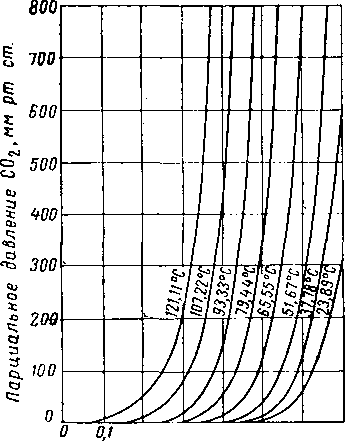
центрации H2S приведены в табл, XVI. 4 [XVI. 59] и на рис. XVI. 32, XVI. 33 и XVI. 34. Равновесные изотермы для С02 в водных растворах, содержащих 12,3—20,90% (по весу) амина, приведены па рис. XVI. 35—XVI. 37 [XVI. 52], Положение изотерм, выражающих растворимость СОг при различных парциальных давлениях С02, значительно меняется в зависимости от температуры. Для данной изотермы самос большое влияние концентрации жидкой фазы наблюдается в интервале низких парциальных давлений СОг.
Таблица XVI. 4 Данные о фазовом равновесии системы сероводород — моноэтаноламин — вода [XVI. 59]
Число молей H2S на 1 моль амина для растворов моноэтаноламина, скорректированное на идентичную величину молярности амина
| Парци | Молыюсть амина | ||||||
|
альное | |||||||
| давле | |||||||
| ний. | 0,6 | 1.0 | 1,5 |
2.0 | 3,0 | 4.0 |
5,0 |
| рт. ст. | |||||||
| При 25° С | |||||||
| 700 | 1,148 |
1,086 | 1,050 | 1,033 |
1,011 | 0,998 |
0,991 |
| 600 |
1,126 | 1,072 | 1,041 |
1,025 | 1,004 |
0,991 | 0,984 |
|
500 | 1,101 | 1,058 |
1,032 | 1,016 | 0,996 | 0,980 | 0,974 |
| 400 | 1,080 | 1,042 | 1,020 | 1,006 |
0,985 | 0,971 | 0,963 |
| 300 | 1,053 |
1,022 | 1,002 | 0,990 |
0,970 | 0,955 |
0,945 |
| 200 |
1,027 | 0,998 | 0,979 |
0,966 | 0,946 |
0,931 | 0,918 |
|
100 | 0,986 | 0,956 |
0,934 | 0,919 | 0,893 | 0,870 | 0,852 |
| 50 | 0,934 | 0,902 | 0,876 | 0,856 |
0,819 | 0,784 | 0,758 |
| 25 | 0,866 |
0,833 | 0,802 | 0,777 |
0,730 | 0,687 |
0,643 |
| При 45° С |
|||||||
| 700 | 1,124 |
1,051 | 1,011 | 0,988 |
0,958 | 0,940 |
0,927 |
| 600 |
1,097 | 1,033 | 0,966 |
0,975 | 0,948 |
0,928 | 0,914 |
|
500 | 1,070 | 1,012 |
0,980 | 0,960 | 0,934 | 0,913 | 0,899 |
| 400 | 1,045 | 0,993 | 0,961 | 0,943 |
0,918 | 0,897 | 0,880 |
| 300 | 1,011 |
0,967 | 0,939 | 0,921 |
0,891 | 0,869 |
0,850 |
| 200 |
0,971 | 0,929 | 0,900 |
0,880 | 0,846 |
0,819 | 0,800 |
|
100 | 0,908 | 0,854 |
0,826 | 0,795 | 0,748 | 0,714 | 0,684 |
| 50 | 0,026 | 0,782 | 0,742 | 0,706 |
0,648 | 0,601 | 0,564 |
| 25 | 0,731 | 0,686 | 0,631 |
0,601 | 0,533 | 0,487 |
0,453 |
| При 60°С |
|||||||
| 700 | 1,083 |
1,040 | 0,998 | 0,968 |
0,934 | 0,909 |
0,891 |
| 600 |
1,056 | 1,011 | 0,970 |
0,944 | 0,910 |
0,884 | 0,865 |
|
500 | 1,027 | 0,984 |
0,945 | 0,916 | 0,880 | 0,858 | 0,837 |
| 400 | 0,995 | 0.952 | 0,912 | 0,885 |
0,848 | 0,821 | 0,801 |
| 300 | 0,960 |
0,916 | 0,876 | 0,847 |
0,810 | 0,778 |
0,753 |
| 200 |
0,908 | 0,863 | 0,822 |
0,793 | 0,751 |
0,714 | 0,683 |
|
100 | 0,811 | 0,757 |
0,708 | 0,674 | 0,62,4 | 0,581 | 0,547 |
| 50 | 0,694 | 0,634 | 0,576 | 0,532 |
0,474 | 0,425 | 0,386 |
| 25 | 0,551 |
0,490 | 0,433 | 0,388 |
0,331 | 0,291 |
0,285 |
Предполагаемые общие реакции между кислыми газами и моноэтаноламином таковы.
Для С02
2HOCH2CH2NH2 + Н20 + С02 ^ (HOCH2NH3)2 С03,
(XVI. 3)
(H0CH2CH2NH3)2C03+ н2о +
+ С02 2 H0C2CH2NH3HC03. (XVI. 4)
Для H2S
2НОСН2 CHNH2 + H2S ^ (HOCH2CH2NH3)2 S + H2S ^
(XV!. 5)
2HOCH2CH2NH3HS. (XVI. 6)
Можно предположить, что при данных температуре и концентрации амина соотношение между бикарбонаг-ной и карбонатной формой увеличивается по мере повышения равновесного парциального давления С02. Аналогично этому высокие парциальные давления H2S повышают концентрацию сульфгидрата амина. Стехиометрическая величина, выражающая полное химическое превращение аминов, при высоких парциальных давлениях кислых газов может быть превышена, потому что в этих случаях химическая реакция дополняется «физическим» растворением [XVI. 46, XVI. 51].
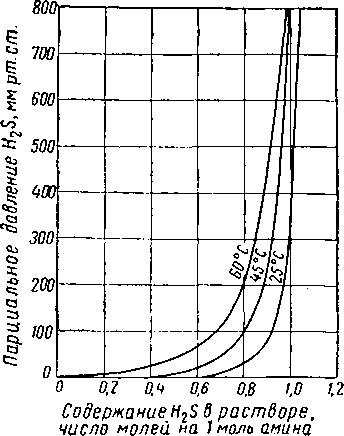
Рис. XVI. 32. Парциальное давление H2S из двухмолярного раствора моноэтаноламина, содержащего 10,9% вес. амина [XVI. 59].
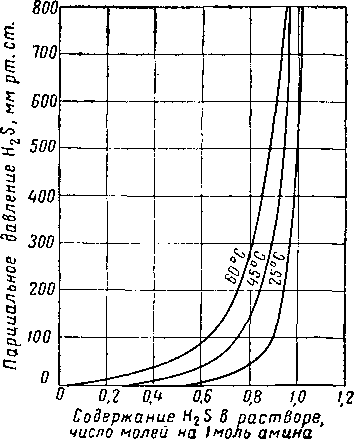
Рнс. XVI. 33. Равновесное давление H2S из трехмолярного раствора моноэтаноламина, содержащего 15,5% вес. амина [XVI. 59].
0,8 1,0 1,2 Содержание H2S 6 растворе, число молей на I моль амина
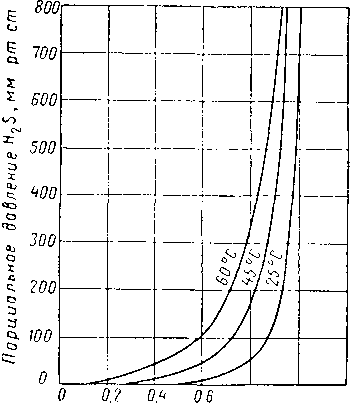
Рис. XVI. 34. Равновесное давление H2S из четырехмолярного раствора моноэта-ноламина, содержащего 19,7% вес. амина [XVI. 59].
О 0,2 0,4 О,Б 0,8 " 10 1,2
Содержание С02 В растворе, число молей на 1 моль амина.
Рис. XVI. 35. Равновесное давление СОг из двухмольного раствора моноэтаноламина, содержащего 12,3% вес. амина [XVI. 52].
0,2 0,3 0,k Q5 0,6 0.7
Содержание С02 В растворе, число молей на1 моль амина
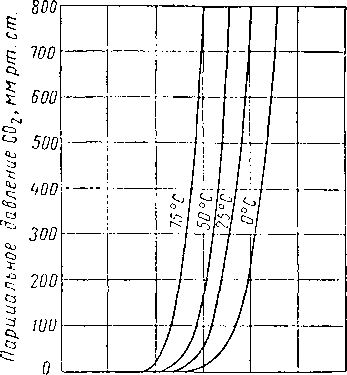
Рис. XVI. 36. Равновесное давление СОг из 15% вес. раствора моноэтаноламина [XVI. 45, XVI. 52].
О 0,2 0.4 О,Б 0,8 1,0 1,2
Содержание C0Z в растворе, число молей на I моль амина
Рис. XVI. 37. Равновесное давление ССЬ из двухмольного раствора диэтанолами-на, содержащего 20,6% вес. амина [XVI. 52].
Растворимость смесей СОг и H2S была изучена Лей-бушем и Шнеерсоном (Leibush and Shneerson) [XVI. 481. Общая растворимость H2S и СОг в смеси оказалась несколько ниже растворимости любого из этих газов при низких парциальных давлениях кислого газа.
Данные о фазовом равновесии для систем вода — амин, которые можно применять для расчетов, связанных с отделением воды от амина в орошаемой части десорбера, приведены на рис. XVI. 38 и XVI. 39.
Данные о плотности водных растворов амина приведены на рис. XVI.40 и XVI. 41, а показатели вязкости и теплопроводности — на рис. XVI. 42—XVI. 44. Изучая возможность применения чистого моноэтанола мина для удаления СОг из инертных газов, Чемберс и Уолл [XIII. 8] нашли, что продуктами реакции между С02 и моноэтаноламином являются жидкости, вязкость которых широко колеблется в зависимости от температуры и концентрации СОо.
15,5 20 30 UO 50 60 70 80
Температура, °С
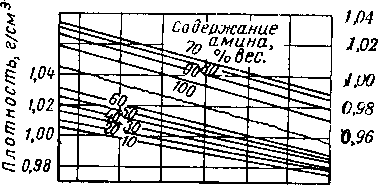
Рис. XVI. 40. Плотность водных растворов моноэтаноламина [XVI. 38].
15,5 20 30 U0 50 60 70 80
Температпура., °С
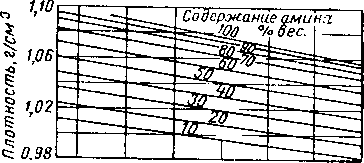
Рис. XVI. 41. Плотность водных растворов диэтаноламина [XVI. 38].
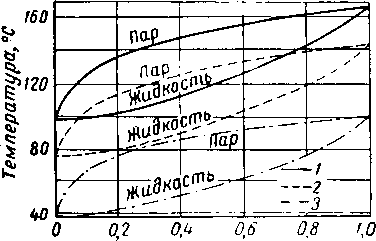
Рис. XVI. 38. Фазовый состав водных растворов моноэтаноламина [XVI. 38].
Давление, мм рт. ст.: 1 — 700; 2 — 300; 3 — 50.
Мольная концентрация моноэтаноламина
15 30 45 60 75 90 105 Температур а, °С

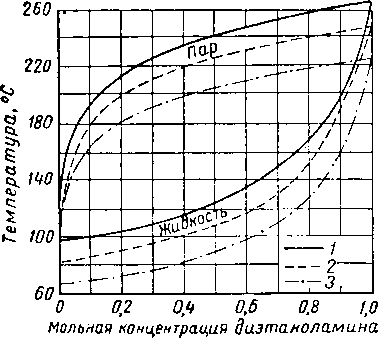
Рис. XVI. 39. Фазовый состав водных растворов диэтаноламина [XVI. 38]. Давление, мм рт. ст.: / — 700; 2 — 400; 3 200.
-25 -15
Рис. XVI. 42. Вязкость водных растворов моноэтаноламина
[XVI. 30].
/ — кривая температуры замерзания; 2— кривая температуры кипения. Абсолютная вязкость [x=vp ; спз — сст 'г/см* «,
^ 0.060 е
4 > OJJ4S
О ч 2-С;
| В | |||||||||
| а\ | |||||||||
|
N | |||||||||
| /1 | |||||||||
| *-— |
10 20 30 W 50 60 70 80 90 100 Содержание амина, % вес
Рис. XVI. 44. Теплопроводность водных растворов моно- и диэтаноламина при 35° С [XVI. 30].
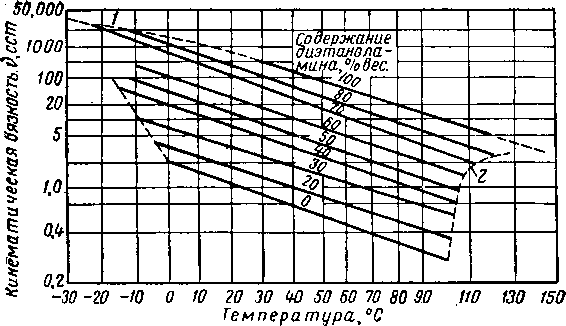
Рис. XVI. 43. Вязкость водных растворов диэтаноламина [XVI. 30].
/ -кривая температуры замерзания; 2 — кривая температуры кипения.
0.030
съ
0,015
А — моноэтаноламин; В — днэтаноламин.
3. ТЕРМОДИНАМИЧЕСКИЕ ПОКАЗАТЕЛИ
Имеющиеся в литературе данные о теплоте абсорбции С02 и H2S очень немногочисленны [XVI. 28]. Расчеты абсорбции кислых газов в водных растворах моноэтаноламина — диэтилен-гликоля [XVI. 44], произведенные на основе показателей теплоты абсорбции и температурного профиля колонны (рис. XVI. 47), показывают, что теплота абсорбции ограничивает допускаемую концентрацию моноэтаноламина в ненасыщенном растворе. При использовании растворов с высокой концентрацией амина теплота, выделившаяся во время химической реакции, может вызвать десорбцию кислых газов на каких-либо промежуточных тарелках в абсорбере. Людковская и Лейбуш (Lyudkovskaya and Leibush) [XVI. 51] рассчитали парциальную теплоту растворения СО2 в водных растворах моно- и триэтаноламина и нашли, что она зависит от концентрации амина. Впоследствии йоризан (Yorizane) [XVI. 66] произвел термодинамический анализ системы сероводород—моноэтаноламин
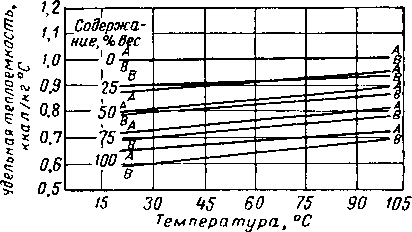
Рис. XVI. 46. Удельная теплоемкость водных растворов моно- и диэтаноламина [XVI. 30].
А — моноэтаноламин; В—диэталолампн.
Термодинамические показатели необходимы для расчета скоростей процессов, а также для составления тепловых и материальных балансов. Теплота парообразования растворов моно- и диэтаноламина приведена на рис. XVI. 45 [XVI. 38], а удельная теплоемкость их водных растворов — на рис. XVI. 46 [XVI. 30].
Температура, °С
Рис. XVI. 45. Скрытая теплота испарения растворов моно- и диэтаноламина как чистых веществ (в пересчете на 100% амина).
I — моноэтаноламин; 2 — днэтаноламин..
Температура раствора, °С 30 45 60 75 90 105 120
Обога
щенный
раствор
Cbipofi1 газ
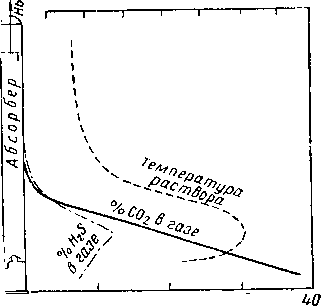
О 10 20 30
Содержание кислого газа в природном газе, %
Ненасы-*-щенный р а створ. Нерхняя
тарелка
Рис. XVI. 47. Кривые состава газа и температуры в абсорбере во время очистки газа А-4 [XVI. 44].
20 моль
1.0 моль
?
Cj
a**'»
^¦S сз •
Й 0 S *
Qj —,
C C3
Q; J
C3 * 3: oo
-O C4J
^3: Cj t* з 4 Cf 3;
ci aj §t
-7
-8
¦10
¦12
¦14
-16
| ЛС КЧ°С |
|||||||||||
|
31Р\ |
3118°с |
||||||||||
| 60S | 60°? | ||||||||||
| loo °i. | |||||||||||
| юо:е | — | ||||||||||
О 200 400 600 0 200 400 600 0 200 400 600 800
Парциальное давление H^S, мм рт. ст.
Рис. XVI. 48. Теплота растворения H2S в растворах моноэтаноламина [XVI. 69].
3,0 моль
с целью определения парциальной теплоты растворения H2S в водных растворах моноэтаноламина. Хотя правильность этих данных не была подтверждена экспериментально, расчеты показывают, что парциальная теплота растворения H2S в моноэтаноламине является ярко выраженной функцией температуры, концентрации амина и парциального давления H2S в газовой фазе. Расчетные величины теплоты растворения как функции этих переменных показаны иа рис. XVI. 48—XVI. 50. Поскольку обычно в аминовой установке равновесные условия вследствие ограничений, создаваемых скоростными эффектами, не достигаются, в качестве величины парциальной теплоты растворения H2S при технологических расчетах рекомендуется применять величину парциальной теплоты растворения при нулевом парциальном давлении H2S и при данных рабочей температуре и концентрации амина. Единственная. экспериментально полученная величина парциальной теплоты растворения СОг в моноэтаноламине приводится Грегори и Шарман-ном (Gregory and Scharmann) [XVI. 43] и составляет 400 ккал на 1 кг поглощенного СОг Боттомс (Bottoms) [XVI. 28] сообщает, что в нормальных условиях работы абсорбера теплота растворения составляет 360 ккал на 1 кг поглощенной СОг и 284 ккал на 1 кг поглощенного H2S.
I
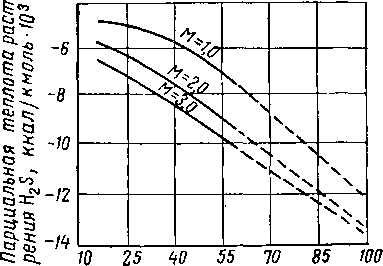
Рис. XVI. 50. Теплота растворения H2S в растворах моноэтаноламина при парциальном давлении H2S. равном 500 мм рт. ст. [XVI. 66].
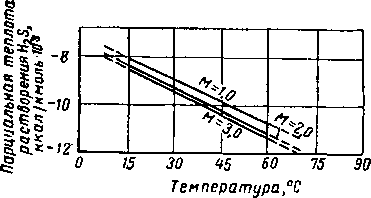
Рис. XVI. 49. Теплота растворения H2S в растворе моноэтаноламина при парциальном давлении H?S, равном нулю [XVI. 66].
Ранее были представлены типовые равновесные соотношения для систем, состоящих из кислых газов, органических аминов и воды. При формальном расчете абсорберов — с насадкой или тарелочных — необходимо принимать во внимание скорость абсорбции. По опубликованным данным для установок, .работающих с растворами моноэтаноламина, извлечение СОг составляет 0,9— 1,5 л/л на 1% вес, моноэтаноламина. Степень извлечения определяется как разность между содержанием СОг в газе на входе и выходе из абсорбера. Для поддержания оптимальной вязкости, уменьшения коррозии и обеспечения теплоемкости, достаточной для поглощения высокой теплоты растворения кислых газов в растворе амина, концентрацию амина в поглощающем растворе обычно принимают в 10—30% вес, Абсорберы обычно
имеют 15—30 тарелок или эквивалентное количество насадки. Для уменьшения коррозии рекомендуется [XVI. 39, XVI. 60] поддерживать относительно небольшой поток жидкости в колоннах и трубопроводах и низкую температуру при регенерации.
Диаметры колонн с колпачковыми тарелками можно определить обычными методами. Принципы расчета колонн с насадкой были даны несколькими авторами [XVI. 49, XVI. 58]. В литературе имеются данные о скорости массопоредачи при абсорбции С02 в водных растворах моно- и диэтаноламина в колоннах с насадкой [XVI. 34, XVI. 47].
Влияние типа амина на общий коэффициент поглощения для 1" колонны с насадкой приведено в табл. XVI. 5. Следует отметить, что низкий коэффициент массообмена растворов триэтаноламина препятствует использованию их в обычных контактных установках.
Таблица XVI. 5 Относительное влияние амина на общий коэффициент поглощения для колонны с насадкой [XVI.47, XIII.37]
Расход жидкости 3400 кг/ч-м-', мольная концентрация С02 в газе 3—5%; в карбонат превращаются Ъ% амина; температура процесса 50° С
|
Коэффициент | |
| Амины | поглощения, |
| кмоль/ч-м.3-ат |
2-мольный моноэтанола мин
110,5
45,4
4,74
2-мольный диэтаноламин . .
3-мольный триэтаноламин .
На основании работы Кола (Kohl) [XVI. 46] можно рассчитать абсорбцию СОг водными растворами моноэтаноламина по отдельным тарелкам. Метод Кола будет кратко изложен здесь, поскольку при наличии экспериментальных данных об эффективности тарелок аналогичная методика может быть положена также в основу расчета абсорбции H2S и смеси кислых газов и природных. Абсорбцию кислых газов в органических растворах следует рассматривать как процесс маосообмена, при котором одновременно протекают абсорбция и химическая реакция. Равновесные соотношения характеризуются низким равновесным парциальным давлением реагирующего газа, что обеспечивает макоимум проявления движущих сил и тем самым ускоряет и повышает степень абсорбции. В дополнение к созданию максимальной силы увлечения газовой фазы быстрое удаление кислых газов с поверхности раздела газ—жидкость при химической реакции приводит к повышению скорости массобмена [XVI. 55]. В результате общая скорость массообмена значительно выше скорости растворения С02 в воде [XVI. 65]. Однако СОг и H2S медленно растворяются в водных растворах; несмотря на большую скорость химической реакции на поверхности раздела между газом и жидкостью, общий к. п. д. та.релок невелик (9—23%) [XVI. 55]. Установлено, что в типичных абсорберах, предназначенных для удаления СОг, 85—95% общего сопротивления приходится на долю сопротивления в пленке жидкости. Вследствие низкого к. п. д. тарелок и совпадения линии равновесия с линией нулевого парциального давления производить расчет по равновесным ступеням не имеет смысла. Поэтому Коль использует эффективность действительных тарелок, выраженную показателем эффективности всей тарелки по пару, найденным по методу Мерфри. Этот показатель
1,2 X 10
^0
|1 +1,2 (0,5- С)Ме
Уп+l -Уп
(XVI. 7)
MV ~ Уп+1
где?м — эффективность всей тарелки по пару (по методу Мерфри); уп+\—мольная концентрация кислого газа, поступающего на тарелку п (уходящего с тарелки га+0); Уп — мольная концентрация кислого газа, уходящего с тарелки п.
Следует отметить, что эффективность по пару (по Мерфри), взятая в определенной точке, в цифровом выражении равна эффективности всей тарелки по пару (по Мерфри), поскольку равновеоный состав газа, уходящего с данной тарелки, по существу такой же, что и в любой точке тарелки, а именно характеризуется нулевым содержанием СОг или H2S.
Составленная Колем [XVI. 46] корреляция эффективности абсорбции СОг в водных растворах моноэтаноламина на отдельных тарелках, основана на следующих допущениях.
1. Упругость паров СОг, находящейся в равновесии с моноэтаноламином, равна нулю.
2. Скорость абсорбции определяется сопротивлением пленки жидкости, несмотря даже на быстрое протекание химичеокой реакции второго порядка.
3. Произведение площади поверхности контакта между фазами на общие коэффициенты газовой пленки изменяется прямо пропорционально концентрации амина и разности между концентрацией СОг в растворе и ее равновесной величиной и обратно пропорционально вязкости в степени 0,68.
4. Зависимость коэффициента сопротивления пленки газа от температуры и парциального давления можно выразить в виде простой показательной (экспоненциальной) функции.
5. Площадь контактной поверхности для данного газа является функцией одной лишь скорости движения газа через прорези.
Эмпирические коэффициенты, учитывающие влияние парциального давления и температуры и показатель степени вязкости, были определены на основании данных Лейбуша и Шнеерсона (Leibush and Shneerson) [XVI. 47]. Окончательная корреляция показана на рис. XVI. 51, а корреляция для поверхности раздела — на пне. XVI. 52.
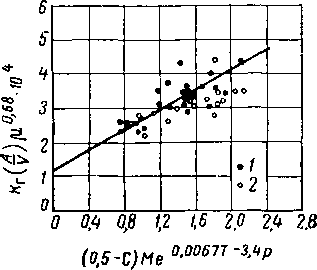
Рис. XVI. 51. Применение уравнения КдИ/К) для абсорбции С02 в тарелочных колоннах [XVI. 46].
0,0067 Г— 2,ip, \
по секциям «з
/ — по всей колонне; 2
4—8 тарелок,
В уравнении, приведенном на рис. XVI. 51, применены следующие условные обозначения:
Кг—общий коэффициент пленки газа, кмоль/ч -м2\ р.— вязкость в спз; С — концентрация С02 в растворе в числах молей на 1 моль моноэтаноламина; А — поверхность контакта тарелки в ж2 на 1 м2 тарелки; М — мольная концентрация амина в растворе в г/моль/л;
*
*
с>
с>
*
Осэ
о
*
>
сз
с:
с>
i:
ос
<§
| \\ V • |
• \ • \ V \ |
- | |
| \ ч \ ч \ • N \ \ • ' \ * гч | «ч. • | ||
| — / • 2 о 3 |
• |
60
3,0
С? Оо 1U ^ ^
Ct5
f? сэ с;
•С ?. C\J
i:
за?»
w е§* =-> ?
8 x ас S.
Я tt-S
6 §3» »«§'
Cj ti
2 Is
0 <=: s
9.0
Линейная скорость газа через прорези (или диафрагму),м/сек
Рис. XVI. 52. Влияние скорости прохождения газа через прорези на поверхность раздела фаз в колпачковых колоннах [XVI. 46].
1 — данные Ван-Кревелена и Хоффейзера для диафрагм; 2— абсорбер атмосферного давления: 3 — абсорбер, работающий при избыточном
давлении 12,1 ат.
Рис. XVI. 53. Влияние концентрации моноэтаноламина на скорость абсорбции [XVI. 36].
Т—температура в лого газа в ат\ V ¦ на ж2 тарелки.
С; р — парциальное давление кне-действительный объем газа в ж3/-(
После этого эффективность тарелки по пару (по Мерфри) сопоставляется с общим коэффициентом пленки газа по уравнению
-10.76 Kr(A/V)RTa
(XVI. 8)
где А/V берется по рис. XVI. 52; R — газовая постоянная = 0,08205 ж3- ат/кгмоль • °С; Та — абсолютная температура в °К.
Вычисление величины эффективности тарелок по пару (по Мерфри) Емп можно применять для определения соотношений между концентрациями газа, раствора и числом теоретических тарелок. Нужно отметить, что графически невозможно получить соотношение между расходами газа и жидкости вследствие того, что наклон равновесной линии по существу равен нулю [XVI. 37].
Проблемой повышения скорости абсорбции ССЬ в чистом моноэтаноламине заинтересовались в Англии [XVI. 31, XVI. 36]. Было установлено, что при повышении концентрации моноэтаноламина в растворе свыше 60%
об. скорость абсорбции СОг значительно возрастает во время образования капель. Относительная скорость абсорбции С02 во время каплеобразования для различных концентраций в абсорбенте амина показана на рис. XVI. 53 [XVI. 36]. Концентрированные растворы амина обеспечивают также высокую поглотительную способность.
На основании объяснения, что скорость абсорбции газа во время образования капли (или пузырька) очень высока вследствие турбулентности, возникающей внутри капли во время ее образования [XVI. 37], было рекомендовано использование центробежных абсорберов [XVI. 31, XVI. 36]. Полагают, что непрерывное образование новых поверхностей раздела в центробежных абоорберах приведет к высокой эффективности контакта [XVI. 36]. Будут ли получены при исследовании результаты, применяемые в промышленной очистке газа, в настоящее время определить трудно.
Отсутствие данных о к. п. д. тарелок и их тепловой характеристике не позволяет производить точные расчеты выпарной колониы. Вместо них используют тепловой и материальный балансы, основанные на состоянии потоков на выходе и входе в выпарную колонну.
Изменение температуры и состава в колонне и рибой-лере установки, использующей водный раствор гликоля и амина, приведено на рис. XVI. 54. Содержание воды в растворе над тарелкой питания быстро поднимается и приближается к 100% на верхней тарелке.
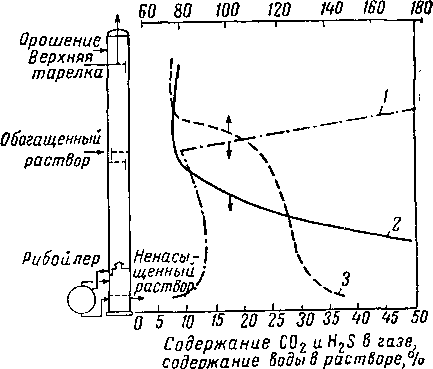
Рис. XVI. 54. Кривые состава газа и температуры в колонне и рнбойлере при очистке газа А-2 [XVI. 44].
1 — содержание I! и О в растворе: 2 — содержание Н 2S + + СОз в газовой фазе; 3 ~~ температура раствора в °С.
Чтобы потери амина с верхним продуктом были незначительными, температура верхней тарелки должна составлять 65—88° С. Зависимость парциального давления моноэтаноламина от температуры контакта показана на рис. XVI. 55. В этих условиях питание предварительно подогревают до температуры, немного превышающей 93° С. Коэффициент орошения при десорбции раствора гликоля—амина составляет от 0,09 до 0,12 л поды на 1 н¦ м3 кислого газа, извлекаемого во время десорбции [XVI. 44]. При температурах, допустимых с точки зрения предотвращения избыточной коррозии, полная регенерация ненасыщенного раствора невозможна. По имеющимся данным [XIII. 37] при мольной концентрации моноэтаноламина в 23,2% и при температуре регенерации 136,7° С концентрация ненасыщенного раствора составляет 0,29 л/л на 1% моноэтаноламина. Значительно меньшую концентрацию СО2 имеют ненасыщенные растворы из гликоль-аминовых десорберов, работающих при температуре рибойлера 149° С [XVI. 44].
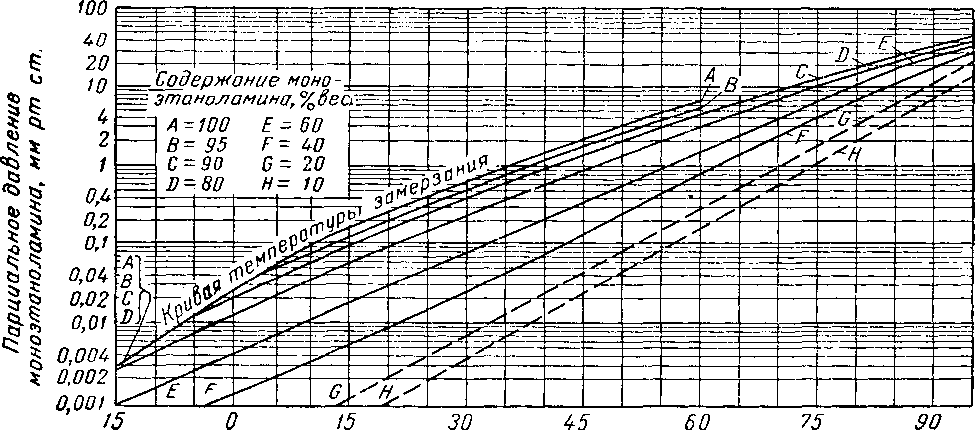
15 30 45 60
Температура контакта, °С
Рис. XVI. 55. Летучесть водных растворов моноэтаноламина [XVI. 30].
Потребность в паре из рибойлера колеблется от 0,06 до 0,14 кг/л раствора в зависимости от эффективности подогревателя питания и температуры десорбции.
Производительность конденсатора верхнего продукта можно вычислить, исходя из температуры верхней тарелки, коэффициента орошения и количества кислого газа, выходящего из регенератора с верхним продуктом. Отсюда следует,, что количество воды, выходящей с верхней тарелки, можно определить по уравнению
![]()
где W — число молей воды в паре, выходящем с верхней тарелки; С — число молей кислого газа, выходящего с верхней тарелки; рв — упругость паров воды при температуре верхней тарелки; р — общее давление на верхней тарелке.
Тогда производительность конденсатора будет равна по существу тепловой отдаче, необходимой для охлаждения кислого газа и конденсации воды.
Тепловая отдача рибойлера рассчитывается по уравнению материального и теплового балансов всей колонны. При этом следует учесть теплоту разложения солей амина во время десорбции (регенерации).
6. КОРРОЗИЯ В ГАЗООЧИСТНЫХ УСТАНОВКАХ
При проектировании и эксплуатации газоочистных установок большое внимание должно быть уделено коррозии конструктивных элементов. Одна из фирм перечисляет трудности, связанные с эксплуатацией очистных установок, в следующей последовательности; коррозия, потери амина и перебои в работе, вызываемые ценообразованием, снижение эффективности поглощающего раствора и т. д. [XVI. 39]. На основании практических наблюдений и исследовательской работы были рекомендованы растворы, способные уменьшить коррозию [XVI. 33, XVI. 39]. Паредес (Paredes) [XVI. 54] показал, что регенерация раствора амина уменьшает коррозию.
По/вышенную неустойчивость к коррозии материалов, испытывающих приложенное или остаточное напряжение, называют коррозией от напряжения [XVI. 57]. В установках очистки амином этот тип коррозии связан с остаточными напряжениями, например, в сварных швах, вызванными местным нагревом. Одной из характерных черт коррозии от напряжения является то, что трещины проходят между зернами материала. Имеется несколько сообщений [XVI. 42] о разрыве различных элементов газоочистных аминовых установок вследствие коррозии от напряжения (рис. XVI. 56), Трещины отмечались исключительно в околошовной зоне в абсорберах, десор-берах и даже трубопроводах. Коррозию от напряжения можно предотвратить снятием напряжений (это осуществляется термической обработкой) во всех основных элементах установок, находящихся в контакте с коррозионными газами и растворами [XVI. 33, XVI. 42].
Кроме того, коррозия в газоочистных установках происходит под действием продуктов разложения и окисления аминов, кислых газов в присутствия сконденсировавшейся воды.

Рис. XVI. -56. Пример разрыва элементов газоочистных аминовых установок вследствие коррозии от напряжения.
Расположение магнитного порошка показывает трещиньъ возникшие вследствие коррозии от напряжения близ сварного шва, соединяющего спусковой патрубок диаметром 50 мм с днищем абсорбера [XVI.40 а]Г
При температурах регенерации моно- и диэтанолами-ны разлагаются, образуя агрессивные соединения. Анализ моноэтаноламина до и после продолжительного нагрева с целью определения концентрации первичного амина, щелочности и общего содержания азота в растворе показывает, что нагрев приводит к существенному изменению свойств раствора [XVI. 39, XVI. 561. Одним из происходящих при этом изменений является увеличение способности аминов растворять порошкообразное железо. Коррозий.ность отработанных аминовых растворов можно значительно уменьшить путем повторной перегонки части циркулирующего потока в восстановителе [XVI. 54]. Агрессивный характер кислых газов в присутствии сконденсированной воды давно известен. В выпарных колоннах, в которых используются водные растворы гликоля — амина, коррозия стали была обнаружена там, где вследствие снижения температур появляется сконденсировавшийся водяной пар. В теплообменниках масло — амин, в которых поддерживается температура порядка 245° С, коррозия очень значительна. В связи с этим в определенных условиях оказалось более рациональным применять алюминиевые сплавы [XVI. 61].
Феган (Feagan) и другие [XVI. 39] рекомендуют следующие мероприятия для уменьшения коррозии в установках очистки амином.
1. Подача в рибойлер нагревающего агента с температурой менее 240° С.
2. Использование растворов с низкой концентрацией амина (10—20% вес.).
3. Использование восстановителя (специального фракционатора) для перегонки амина.
4. Использование эффективного фильтра для циркуляционного раствора.
5. Снятие напряжений в основных узлах установки.
6. Использование низкого давления при регенерации.
7. Использование соответствующих металлов.
Кроме того, рекомендуется применять колонны с насадкой, имеющие внутреннюю цементную футеровку.
7. ПРЕВРАЩЕНИЕ H2S В ЭЛЕМЕНТАРНУЮ СЕРУ
Сероводород, извлеченный из сернистых природных газов, можно превратить в элементарную серу [XVI. 40а]. Этот процесс основан на частичном окислении H2S в парообразной фазе в S
H2S ~t" V2 О2 -» Н20 -j- S. (XVI. 10)
Основными проблемами, связанными с процессом производства элементарной серы из H2S, являются регулирование теплоты, возникающей вследствие экзотер-мичности реакции, и получение жидкой серы после прохождения ее через каталитический реактор. Технологическая схема процесса получения серы «Джефферсон Лейк» показана на рис. XVI. 57.
Имеется много промышленных установок, вырабатывающих серу из сероводорода, извлеченного из природного газа.
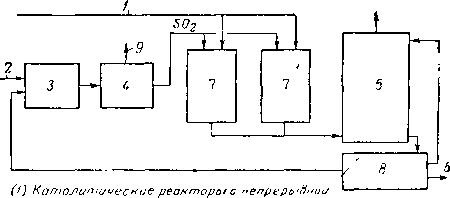
регенерацией к атализотора
Рис. XVI. 57. Получение серы из потока с небольшим содержанием H2S [XVI. 40а].
/ — поток с низким содержанием H2S ; 2 — воздух; 3~ сжигание серы; 4 — паровой котел-экономайзер; 5 — адсорбер для очистки жидкой серы; 6 — товарная сера; 7 — каталитические реакторы с непрерывной регенерацией катализатора; 8 — емкость для жидкой серы; 9 — выходное отверстие.
Природный газ транспортируется в районы потребления по магистральным трубопроводам.