Глава 9 арены и гибридные углеводороды нефти
Глава 9
АРЕНЫ И ГИБРИДНЫЕ УГЛЕВОДОРОДЫ НЕФТИ
9.1. ТИПЫ АРЕНОВ И СОДЕРЖАНИЕ
В НЕФТЯХ И НЕФТЯНЫХ ФРАКЦИЯХ
Содержание аренов в различных нефтях изменяется в широких пределах и составляет, как правило, от 15 до 50 %. Среднее содержание аренов, по данным о составе 400 нефтей, в мало-парафинистых нефтях составляет 37,4 %, среднепарафинистых
30,6 %, высокопарафинистых 20,8 %. (К малопарафинистым отнесены нефти, содержащие менее 1 %, среднепарафинистым — от 1 до 7% и высокопарафинистым — свыше 7% твердых углеводородов.)
Арены представлены в нефтях бензолом и его гомологами, а также производными би- и полициклических углеводородов. В нефтях содержатся и гибридные углеводороды, включающие не только ароматические циклы и алкановые цепи, но и насыщенные циклы.
Арены нефти изучены лучше, чем углеводороды других классов. Многие индивидуальные арены были выделены из нефтяных фракций при помощи методов, основанных на использовании повышенной реакционной способности, избирательной адсорбции, растворимости в полярных растворителях, высоких температур плавления аренов.
Так, в результате многолетних исследований Ф. Д. Россини и сотрудниками в 30—60-х гг. из нефти месторождения Понка-Сити (США) было выделено, идентифицировано и определено содержание свыше 100 аренов, в основном из бензиновых фракций. В бензиновых фракциях присутствуют бензол, толуол и все теоретически возможные изомеры аренов Се и Сэ. В нефти Понка-Сити соотношение аренов Се: С7: Се: Сэ = 1 : 3 : 7 : 8.
Содержание бензольных углеводородов в бензиновых фракциях различных нефтей, как правило, возрастает с увеличением числа заместителей, связанных с кольцом, и снижается с увеличением длины алкильной цепи. Так, в нефти Понка-Сити объемное содержание толуола, этилбензола, пропилбензола и бутил-бензола составляет соответственно 0,51; 0,19; 0,09 и 0,0*26 %.
Преобладающими аренами в бензиновых фракциях являются толуол, ж-ксилол и псевдокумол (1,2,4-триметилбензол). Соотношение содержания индивидуальных аренов остается приблизительно одинаковым для нефтей различных типов. Например, во всех нефтях грег-бутилбензола содержится приблизительно в 50 раз меньше, чем псевдокумола.
Гомологи бензола состава Сю содержатся в основном во фракции 180—200 °С. Среди них преобладают тетраметил- и диметилэтильные производные. Углеводороды бензольного ряда содержатся в большем количестве, чем би- и полициклические арены, и в более высококипящих фракциях — керосиновых, га-зойлевых и даже масляных. Типичные структуры молекул ареной и гибридных углеводородов средних и высококипящих нефтяных фракций приведены ниже.
Анализ бензольных углеводородов фракции 230—275 °С показал, что они представлены в основном структурами типа (I) —ди- или тризамещепными производными, имеющими одну
Арены и гибридные углеводороды средних и высококипящих нефтяных фракций
или две метильные группы и длинную (из 6—8 атомов углерода) слаборазветвленную алкильную цепь. В средних фракциях найдены также производные бензола с алкильными заместителями изопреноидной структуры типа (II). Насыщенная изопре-ноидная цепь может быть как регулярного строения, так и нерегулярного — типа (HI). Эти углеводороды имеют непосредственную генетическую связь с природным Р-каротином.
К гибридным углеводородам с одним бензольным кольцом относятся индан (XIV), найденный в небольшом количестве в бензиновых фракциях, и его гомологи. Из керосиновой фракции выделены тетралин (XV) и его метил производные.
В небольших концентрациях в нефтях найдены углеводороды фенилциклогексановой структуры с неконденсированными кольцами — типа (XVI) или (XVII).
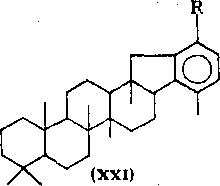
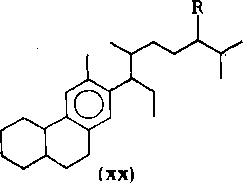
В более высококипящих нефтяных фракциях найдены гибридные моноароматические углеводороды, имеющие три (XVIII), четыре (XIX) или пять насыщенных колец (XXI), генетически связанные с углеводородами ряда гопана. Идентифицированы также моноарены С27—С29 стероидной структуры (XX). Все эти углеводороды, как и производные бензола с изо-преноидными алкильными заместителями, относятся к реликтовым соединениям, подтверждающим органическое происхождение нефти. Хотя концентрация аренов в организмах пренебрежимо -мала, они могли легко образоваться в природе в результате ароматизации на природных катализаторах с незначительным изменением углеродного скелета исходных биологических веществ.
Работы по определению в нефтях биомаркеров — соединений, сохранивших черты строения исходных биоорганических молекул, помимо доказательства биогенной природы нефтей имеют большое практическое значение для поиска месторождений нефти. Всего определено уже около 400 таких биомаркеров. Так, Ал. А. Петровым с сотрудниками изучены биомаркеры состава С19—С35 свыше 500 нефтей пяти основных нефтяных бассейнов России.
В керосиновых фракциях содержатся нафталин (IV) и его гомологи. Концентрация метилпроизводных выше, чем незамещенного нафталина, как и толуола по сравнению с бензолом. Найдены в нефтях и бифенил с гомологами, однако их содержание значительно уступает концентрации углеводородов нафталинового ряда.
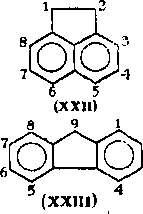
К гибридным углеводородам, присутствующим в газойлевых фракциях, относятся аценафтен (XXII), флуорен (XXIII) и их гомологи. В этих же фракциях содержатся и арены с тремя конденсированными кольцами — фенантрен (V), антрацен (VI) и их алкилпроизводные. Гомологи фенантрена присутствуют в нефтях в значительно большем количестве, чем производные антрацена, что согласуется с относительным распределением подобных структур в растительных и животных тканях.
В высококипящих нефтяных фракциях обнаружены арены с четырьмя конденсированными кольцами — пирен (VII), хри-зен (VIII), 1,2-бензантрацен (IX), 3,4-бензфенантрен (X). Гибридные углеводороды могут содержать 1—3 ароматических и несколько насыщенных колец. Имеются сообщения об идентификации алкилпроизводных аренОв с 5—7 конденсированными ароматическими циклами: перилена (XI), 1 ,12-бензперилена (XII), коронена (ХШ). С увеличением числа конденсированных колец содержание аренов в нефтях быстро уменьшается.
Среднее содержание аренов, характерное для нефтей России различных типов, следующее, % от суммы аренов:
Хризеновые и бензфлуо- 3 реновые
В высококипящих фракциях и нефтяных остатках кроме конденсированных аренов присутствуют также би- и полиядер-ные системы, состоящие из циклоалкильных или фенилалкиль-ных фрагментов, соединенных длинными алкильными цепями.
А. Ф. Добрянский связывал содержание и характер распределения аренов по фракциям с глубиной метаморфизма нефтей. Он предложил подразделять все нефти на три класса: 1) нефти, в которых велико содержание полициклических аренов, концентрирующихся в высших фракциях; 2) нефти с максимальным содержанием аренов в средних фракциях (250—450 °С); 3) легкие метановые нефти, в которых арены концентрируются во фракциях до 300 °С. Высшие арены и гибридные углеводороды, содержащиеся в молодых.циклоалкановых и циклоалка-ноареновых нефтях, постепенно с повышением степени метаморфизма разукрупняются в результате отщепления алкильных и полиметиленовых группировок. При этом арены переходят в относительно низкокипящие фракции, выход которых увеличивается.
Степень метаморфизма зависит не только от возраста нефти, но и от глубины ее залегания и каталитического влияния пород. Так, с ростом глубины залегания и на участках с аномально высокими температурами концентрация моноциклических аренов в нефтях возрастает.
Соотношение некоторых изомеров полициклоаренов используется как показатель катагенного преобразования нефтей. В мало преобразованных нефтях преобладают а-метил (диметил) замещенные структуры, а в катагенно зрелых нефтях — термодинамически более устойчивые р-метил(димстнл)замещенные углеводороды. Предложено несколько индексов преобразованное™ нефтей, характеризующихся соотношением 2-метил- и 1-метилнафталина, а также различных метилфенантре-нов или 3-метил- и 2-метилбифенилов.
9.2. СВОЙСТВА АРЕНОВ
Физические свойства некоторых аренов, содержащихся в нефтях'в наибольших количествах, приведены в табл. 9.1.
Арены имеют значительно более высокую плотность и показатель преломления, чем алканы и циклоалканы.
Силовые поля молекул аренов, характеризуемые обычно отношением теплот испарения или свободных энергий взаимодействия к объему или площади поверхности молекул, значительно выше, чем у насыщенных углеводородов. Поэтому арены лучше адсорбируются полярными адсорбентами и избирательно растворяются в большинстве полярных растворителей. Исключение составляют лишь полифторсодержащие алифатические и ациклические соединения, лучше растворяющие насыщенные углеводороды, чем ароматические. Эта группа растворителей, в отличие от других полярных соединений, характеризуется меньшими силовыми полями молекул по сравнению не только с аренами, но и с насыщенными углеводородами. Взаимная же
Таблица 9.1. Физические свойства аренов
|
Углеводород | р^°, кг/м3 | 'кип "Ри 0,1 МПа, ”С | *кр’ °с | „20 nD |
|
Бензол | 879,0 |
80,1 | 5,52 |
1,5011 |
| Толуол | 866,9 | 110,6 |
—95,0 | 1,4969 |
| о-Ксилол | 880,2 | 144,4 | —25,2 | 1,5054 |
|
ж-Ксилол | 864,2 |
139,1 | —47,9 |
1,4972 |
|
л-Кснлол | 861,0 |
138,4 | 13,3 |
1,4958 |
| Этил бензол | 867,0 |
136,2 | —95,0 |
1,4959 |
|
Гемимеллитол (1,2,3-триметпбензол) | 894,4 | 176,1 |
-25,4 | 1,5139 |
| Псевдокумол (1,2,4-триметилбензол) |
875,8 | 169,4 |
—43,8 | 1,5048 |
| Мезитилен (1,3,5-триметилбензол) | 865,2 | 164,7 | —44,7 | 1,4994 |
| Кумол (нзопропилбензол) Пропил бензол | 861,8 862,0 | 152,4 159,2 | —96,0 —99,5 |
1,4914 1,4920 |
|
Пренитол (1,2,3,4-тетраметилбензол) | 905,2 | 205,0 |
-6,2 | 1,5203 |
| Дурод (1,2,4,5-тетраметилбеизол) |
— | 196,8 |
79,2 | — |
|
Изодурол (1,2,3,5-тетраметилбензол) | 890,4 | 198,2 | —23,7 | 1,5130 |
| Бифенил | — | 255,6 | 69,0 |
— |
| Нафталин | — | 218,0 |
80,3 | — |
|
Фсиантрен | — |
340,1 | 99,2 |
— |
| Антрацен |
— | 342,3 |
216,0 | -“ |
растворимость соединении, как правило, тем выше, чем меньше различаются силовые поля их молекул.
Температура кристаллизации (плавления) тем выше, чем более симметричны молекулы и чем компактнее они могут упаковаться в кристаллической решетке. Так, наиболее симметричный из изомеров ксилола — п-ксилол — имеет наибольшую температуру кристаллизации, а дурол — значительно более высокую температуру плавления, чем другие асимметричные тетра-метилбензолы. Введение одной метильной группы в симметричную молекулу-бензола приводит к снижению его температуры кристаллизации на 100°С. Конденсированные арены с линейно анйелированными бензольными кольцами типа антрацена имеют значительно более высокие температуры плавления, чем ан-гулярные изомеры типа фенантрена.
Температуры кипения изомерных аренов различаются незначительно. Наибольшую температуру кипения имеют изомеры с расположенными рядом алкильными группами (о-ксилол, ге-мимеллитол, пренитол), имеющие наибольшие дипольные моменты.
Вязкость и плотность алкилбензолов возрастает с увеличением числа метильных групп, а индекс вязкости снижается. Плотность полиметилпроизводных бензола также выше, чем алкилбензолов с тем же числом углеродных атомов, что объясняется их повышенным межмолекулярным взаимодействием.
Арены обладают высокой детонационной стойкостью — высокими октановыми числами. Увеличение молекулярной массы аренов незначительно влияет на их детонационную стойкость. Наличие метильных групп в мета- и пара-положениях приводит к повышению октановых чисел, а в орто-положении — к их снижению.
Арены характеризуются наихудшей воспламеняемостью, низкими значениями цетановых чисел. Так, цетановое число 1-метилнафталина равно нулю. Поэтому топлива с высоким содержанием аренов в быстроходных дизелях не применяют.
Вследствие способности аренов к специфическим взаимодействиям их молекулы ассоциированы друг с другом в результате образования водородных связей или с гетероатомными соединениями нефти вследствие образования л-комплексов. Полициклические арены способны к образованию иглоподобных или пластинчатых структурных элементов. Образующиеся надмолекулярные структуры отличаются от изотропной массы большими упорядоченностью, плотностью, меньшей растворимостью в растворителях.
Химические свойства. Для аренов наиболее характерны реакции члектрофильного замещения: нитрования, сульфирования, галогенирования, алкилирования и ацилирования по Фриделю — Крафтсу, нитрозирования и т. д. Механизм всех этих реакций
+ Х+ —> [(44—х
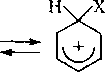
Электрофильному замещению предшествует кислотно-основная реакция, генерирующая атакующую электрофильную частицу Х+. Так, при нитровании электрофилом является ни-троний-катион, образующийся при взаимодействии азотной и серной кислот:
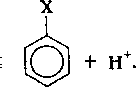
HN03 + 2H2S04 2HS07 + Н30+ + N02+.
При сульфировании ионизация концентрированной серной кислоты протекает с образованием электрофильных реагентов SO3 с электрофильным атомом серы или SOsH+:
2H2S04 ^ S03 + Н30+ + HSO^;
H2S04+S03 ^=± HS04“ + S03H+.
При галогенировании в присутствии сильных кислот или кислот Льюиса (FeCh, AICI3, SnCU и т. д.) образуется положительно заряженный ион галогена:
C12 + H2S04 C1+ + HC1 + HS07;
б+ б-
С12 -(- FeCl3 ^=± Cl —> Cl —> FeCl3 C1+4-FeClJ\
Алкилирование по Фриделю — Крафтсу протекает также в присутствии кислот Льюиса в качестве катализаторов, которые образуют с алкилгалогенидами сначала поляризованные комплексы и в пределе в результате ионизации карбкатион:
е+ б-
RC1 4- А1С13 ^ R — С1 ... А1С13 R+4-AlCl^.
При алкилировании алкенами также образуется карбкатион
+
RCH = СН2 4- H2S04 RCH — СН3 4- HSOJ"
или в присутствии апротонных кислот с сокатализаторами:
+
RCH = CH2+ AICI3+ НС1 + ± RCH-CH34-AIC17.
Далее, как показано выше, электрофил Х+ быстро образует я-комплекс с молекулой ароматического соединения, который может изомеризоваться в несколько более стабильный ст-ком-плекс. В ст-комплексе электрофил связан с молекулой ковалентной связью. В результате на ароматическом кольце возникает целый положительный заряд. При этом один из атомов углерода выключается из сопряжения и переходит из состояния гибридизации sp2 в состояние sp3:
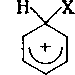
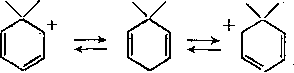
Последняя стадия реакции состоит в отрыве протона от ст-комплекса с образованием молекулы замещенного арена, например:
Н X
Н X
Н X
+
Условно структура бензолоний-иона может быть представлена следующим образом:
С1
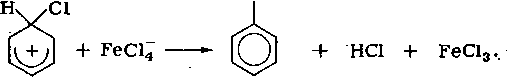
При исследовании механизма реакции электрофильного замещения шведский химик JI. Меландер применил изотопный метод. Оказалось, что соединения, меченные дейтерием и тритием, замещаются с такой же скоростью, что и водородсодержащие аналоги, т. е. заметного изотопного кинетического эффекта для большинства реакций (за исключением реакции сульфирования) не наблюдается. Учитывая, что энергия разрыва связей углерод — дейтерий и углерод — тритий выше, чем энергия связи С—Н, можно заключить, .что последняя стадия реакции электрофильного замещения — отрыв протона — не должна быть лимитирующей. Следовательно, относительно медленной, лимитирующей стадией является образование промежуточных соединений. Известно, что образование я-комплексов— быстрый .процесс, значит, наиболее медленная стадия — изомеризация я-комплекса в о-комплекс. Это подтверждается, например, наличием корреляции между скоростями реакции галоге-нирования гомологов бензола и устойчивостью о-комплексов, в то время как подобная корреляция с устойчивостью л-ком-плексов отсутствует.
Значительно менее характерны для аренов, несмотря на их высокую степень ненасыщенности, реакции присоединения. Бензол, например, не гидрируется в условиях гидрирования алкенов. Тем не менее при гидрировании под давлением в присутствии никелевых катализаторов бензол превращается в циклогексан:
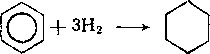
Относительные скорости гидрирования бензола, циклогексе-на и стирола равны соответственно 1, 150 и 900.
Возможна и реакция Присоединения галогенов к бензолу, протекающая по свободнорадикальному механизму в жидкой фазе,с использованием фотохимического метода или инициаторов:
С6Н6 зсь —>¦ С6Н6С16.
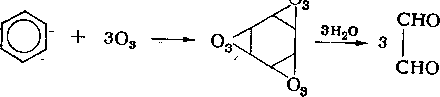
Бензол способен присоединять и озон, давая при разложении образующегося триозонида водой глиоксаль:
о.
Нафталин и полициклические углеводороды — фенантрен, антрацен, хризен, пирен—как и бензол, подчиняются правилу Хюккеля—содержат (4п+2)я-электронов на связывающих молекулярных орбиталях. Молекулы этих углеводородов плоские, для них характерны высокие значения энергий сопряжения и комплекс свойств аренов. В частности, все эти углеводороды, как и бензол, легко вступают в реакции электрофильного замещения.
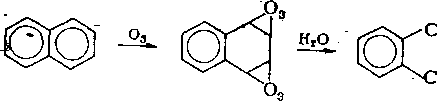
Все конденсированные арены в большей нли меньшей степени приближаются к непредельным соединениям. Так, нафталин значительно менее устойчив и более реакционноспособен, чем бензол. В отличие от молекулы бензола, в которой все угле-род-углеродные связи равноценны, в молекулах нафталина и полициклических аренов связи неравноценны.
В молекуле нафталина связи 1—2, 3—4, 5—6 и 7—8 имеют более высокий порядок, более непредельны и имеют меньшую длину, чем связи 2—3 и 6—7. В молекуле фенантрена наибольшая электронная плотность характерна для связи 9—10, приближающейся по характеру к двойной. Естественно, что реак-
ции присоединения идут по связям с более высоким порядком и с большей скоростью, чем в случае бензола:
сно
:но
сно
+ I
сно
нх
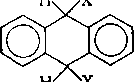
Реакции присоединения к молекулам антрацена идут за счет мезо-положений 9 и 10:
Нч /X
W Хх
При таком направлении реакции присоединения потеря энергии сопряжения оказывается наименьшей: 352—151-2 = = 50 кДж/моль, где 352 и 151—энергии сопряжения молекул антрацена и бензола, кДж/моль.
Именно по положениям 9—10 в молекулах фенантрена и антрацена происходит присоединение молекул малеинового ангидрида по реакции Дильса — Альдера, которая используется для выделения гомологов фенантрена и антрацена из нефтяных фракций.
9.3. ИСПОЛЬЗОВАНИЕ АРЕНОВ В НЕФТЕХИМИЧЕСКОМ СИНТЕЗЕ
Арены, прежде всего бензол, толуол, ксилолы, относятся к наиболее крупнотоннажным нефтехимическим продуктам. Динамика мирового производства аренов (табл. 9.2) свидетельствует о постоянном возрастании их выпуска.
Мировая мощность действующих установок по производству аренов уже практически позволяет обеспечить запланированный
Таблица 9.2. Объем мирового производства аренов, млн т
1998 г. (прогноз)
1981 г.
1985 г.
У глеводороды
18.5 8.7
10.6 37,8
16,5
7,8
9,5
33,8
26.7
12.8 15,3 54,8
Беизол
Толуол
Ксилолы (сумма) Сумма ареиов
уровень 1995 г. Так, к началу 1986 г. общая мировая мощность производств бензола составляла более 25 млн т/год. В 1990 г. объем производства аренов в СССР составлял (тыс. т/год): бензол — 2187; толуол— 1123; ксилолы— 1185.
В России и США основным процессом производства аренов служит каталитический риформинг бензиновых фракций нефти, а в капиталистических странах Западной Европы большую часть аренов выделяют из жидких продуктов пиролиза. Перспективно также получение аренов дегидроциклизацией алканов С3 — С5.
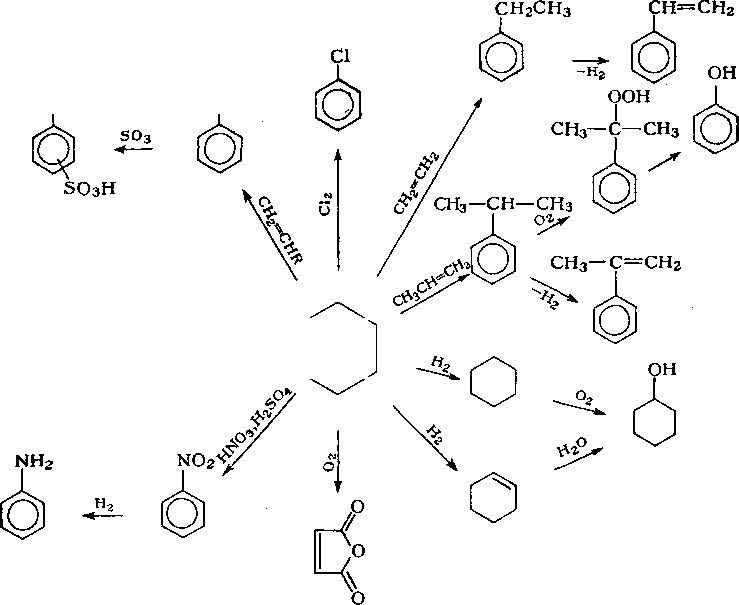
Основные направления использования бензола представлены на схеме 9.1. Крупнейший потребитель бензола — производство стирола из этилбензола, получаемого в свою очередь алкили-рованием бензола этиленом. Около 20 % бензола используется для производства фенола, которое осуществляется в основном кумольным методом. Приблизительно 15 % бензола расходуется на производство циклогексана, необходимого для получения капролактама и адипиновой кислоты. Перспективно производство капролактама на основе циклогексена, получаемого одностадийным гидрированием бензола в присутствии рутениевых катализаторов.
Окислением бензола продолжают получать малеиновый ангидрид. Преимуществом метода по сравнению с конкурирующим с ним окислением бутана является более простая очистка продукта от примесей.
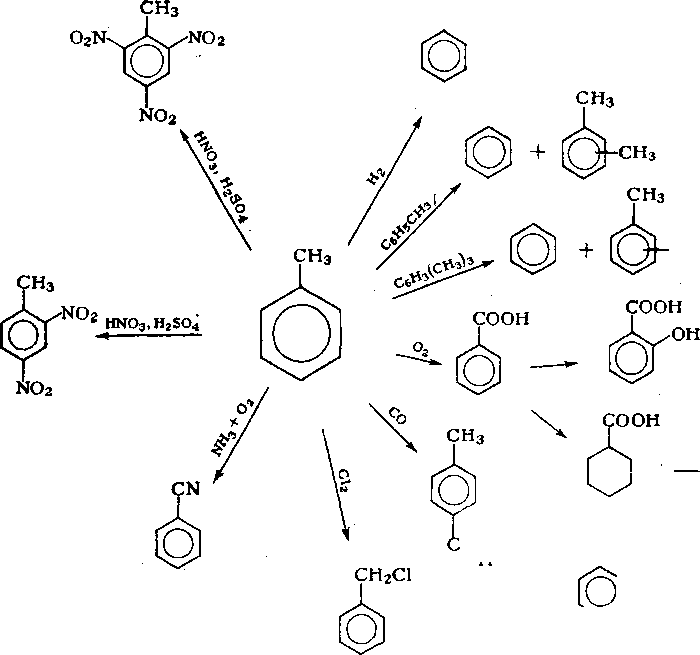
Анилин до настоящего времени производится в основном нитрованием бензола с последующим парофазным гидрированием нитробензола. Можно получать анилин и аммонолизом феиола. Расширение потребностей в анилине обусловлено использованием его в качестве сырья для производства полиуретановых пенопластов.
Алкилированием бензола 1-алкенами с последующим сульфированием и щелочной обработкой производят синтетические моющие средства — алкиларилсульфонаты.
Каталитическим парофазным дегидрированием бензола (катализаторы Си или Со) получают бифенил и п-терфенил — высокотемпературные теплоносители.
Основные направления использования толуола в нефтехимической промышленности представлены на схеме 9.2. Лишь около 15 % производимого толуола служит сырьем для синтеза неуглеводородных органических соединений. Значительная часть толуола перерабатывается в бензол и ксилолы гидродеалкили-роваиием, диспропорциоиированием мстильной группы или трансалкилированием при взаимодействии с аренами Св. Толуол широко используется также как растворитель и как высокооктановая добавка к бензину.
О
СНз—сн—н
S03Na д,СНз—СН—R СН3—СН—R
<ОиОьнО^Оь^О> [Q
Схема 9.1. Основные направления использования бензола в нефтехимической промышленности
СН3
-СОг
ООН

'n' о
ОН
Л
. I н
Схема 9.2. Основные направлении использования толуола в нефтехимической промышленности
Важнейшими направлениями неуглеводородного синтеза на основе толуола являются производство 2,4,6-тринитротолуола — взрывчатого вещества, производство бензойной кислоты и далее— через циклогексанкарбоновую кислоту взаимодействием с нитрозилсерной кислотой — получение капролактама. Окислением бензойной кислоты с использованием солей меди(II) можно получать салициловую кислоту и декарбоксилированием последней — фенол.
n-Толуиловый альдегид получают карбонилированием толуола в присутствии борофтороводородной кислоты, а окислением альдегида можно получить терефталевую кислоту. Хлорированием толуола получают бензилхлорид, окислительным аммоно-лизом — бензонитрил. Нитрованием толуола производят
2,4-динитротолуол, а из него толуилендиизоцианат — мономер для производства полиуретанов.
Основные направления использования изомеров ксилола представлены на схеме 9.3.
Около 16 % суммарных ксилолов используется как высокооктановый компонент бензина, 17%—в качестве растворителя и 67 % разделяется на индивидуальные изомеры. Почти весь о-ксилол потребляется производством фталевого ангидрида, около 75 % которого получается из о-ксилола и 25 % — окислением нафталина.
Большая часть n-ксилола используется для получения из терефталевой кислоты и этиленгликоля полиэтилентерефталата, из которого вырабатывают лавсан. Из n-ксилола получают также n-ксилилен и поли-п-ксилилен — полимер, термостойкий до 220 °С.
ж-Ксилол в основном изомеризуется в о- и л-изомеры. Окислительным аммонолизом лг-ксилола получают изофталонитрил и далее лг-ксилилендиамин, лг-ксилилендиизоцианат и полиуретаны на его основе. Окислением ж-ксилола получают лг-толуи-ловую кислоту и из нее Ы.М-диэтил-лг-толуамид, использующийся как репеллент. Из лг-ксилола можно получить 2,6-ксиленол, а из него— термостойкий полимер — поли-2,6-диметил-1,4-фени-леноксид. При хлорметилировании ксилолов, гидролизе хлорме-тильных производных и последующем окислении образуется пи-ромеллитовый диангидрид, из которого получают высокотермостойкие полимеры.
Пиромеллитовый ангидрид производится в основном другим методом — окислением дурола:
О
О
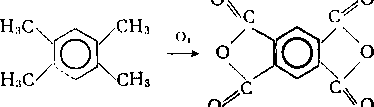
СУ
о
о
о
2
а
X
и
НОСН2СН2 —OOC—(( ))—СООСН2СН2— он
Схема 9.3. Основные направления использования ксилолов в нефтехимической промышлеиности
к
ъ
СЧ
к
и
°ч /°\ f
и и
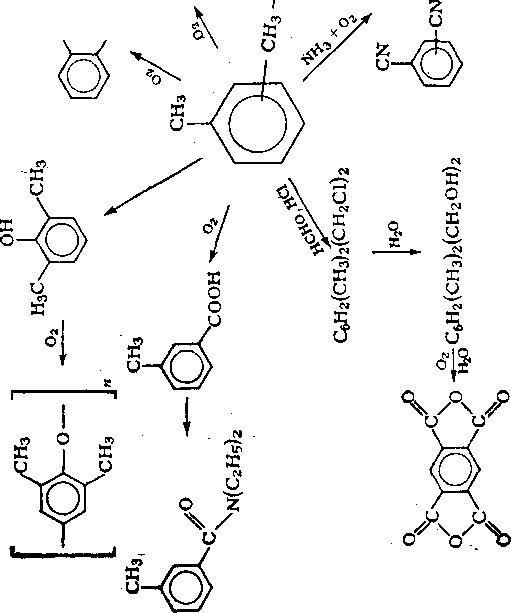
Все более широкое применение находят арены Сэ. Окислением псевдокумола получают тримеллитовый ангидрид, использующийся для производства термостойких пластмасс. На основе псевдокумола синтезируют также красители и витамин Е.
Окислением мезитилена получают тримезиновую кислоту и на ее основе — полимерные материалы. Нитрованием мезитилена и последующим восстановлением нитропроизводного синтезируют мезидин — полупродукт в производстве красителей.
Нафталин используют для производства фталевого ангидрида, инсектицидов, 1- и 2-нафтолов. Последние получают щелочным плавлением 1- и 2-нафталинсульфокислот. Нагреванием 2-нафтола с водным раствором сульфита и бисульфита аммония получают 2-нафтиламин:
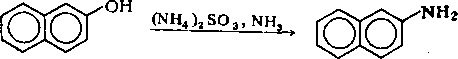
Нафтол- и аминосульфокислоты применяют для производства азокрасителей.
Алкилированием нафталина хлоралканами получают «пара-флоу» — депрессоры, добавляемые к смазочным маслам для понижения температуры застывания:
AIC1,
СюНв + 2C25H51CI -—> СюН6 (C2sH5i)2 + 2НС1.
Окислением 2,6-диалкилпроизводных нафталина синтезируют нафталин-2,6-дикарбоновую кислоту, идущую для производства полимерных волокон.
Алкилнафталины взаимодействуют с формальдегидом в присутствии кислых катализаторов (например, муравьиной кислоты) с образованием термопластичных смол.
Окислительная переработка углеводородного сырья наряду с такими процессами, как пиролиз, полимеризация, гидрирование, занимает в современной нефтехимии важнейшее место.
Окисление аренов. Для получения кислородсодержащих ароматических соединений используется как парофазное, так и жидкофазное окисление.
Окисление бензола. Окисление бензола в малеиновый ангидрид проводят в паровой фазе на стационарном катализаторе. Массовое соотношение воздух: бензол можно менять в широких пределах —от 5 до 300. В зависимости от вида катализатора температуру в реакторе поддерживают в интервале 250—600 °С.
При использовании ванадийоксидного катализатора оптимальная температура 300—400 °С, а молибденоксидного 425— 475 °С; давление от 0,5 до 1 МПа. Время пребывания паров бензола в реакционной зоне от 0,01 до 5,0 с.
О
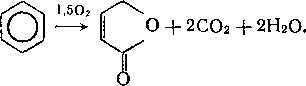
Бензол окисляется по двум независимым путям: а) окисление в малеиновый ангидрид; б) полное сжигание до СОг и Н20. Конверсия бензола в малеиновый ангидрид составляет 57—63 %.
Разработан процесс некаталитического парофазного окисления бензола непосредственно в фенол в промышленном масштабе (600—800 °С, 0,05—0,02 МПа). Выход фенола 50%.
Окисление изопропилбензола (кумол а) с получением фенола и ацетона. Проводится по кумоль-ному методу, разработанному П. Г. Сергеевым, Б. Д. Кружа-ловым и Р. Ю. Удрисом.
Основные стадии кумольного метода — окисление кумола в гидропероксид и кислотное разложение гидропероксида. Окисление проводят двумя способами: 1) в водно-щелочной эмульсии при 130 °С и давлении 0,5—1 МПа кислородом воздуха до конверсии 25 %; 2) в жидкой фазе при 120 °С кислородом воздуха в присутствии катализатора — меди (в виде насадки) или солей металлов переменной валентности (нафтенаты, резинаты).
Жидкофазное окисление кумола протекает в основном по наименее прочной третичной С—Н-связи. Наличие бензольного кольца в a-положении к третичной связи приводит к значительному ее ослаблению («310 кДж/моль), поэтому процесс окисления протекает при низких температурах с высокой селективностью по гидропероксиду.
При 70—80 °С гидропероксид кумола устойчив, и реакция окисления углеводорода протекает как цепная неразветвленная по следующей схеме:
инициирование цепи
о,
CeHsCH (СНз)з —> С„Н5С (СНз)з + НОз;
продолжение цепи
о,
С„Н5С (СНз)з —> СвН,С (СНв)з ОО •; СвНвС (СНз)э ОО • + СвН,СН (СНз)з —> —> СвН5С (СНз)а ООН + СвН5С (СН,)а;
обрыв цепи
2С2Н5С (СНзЬ 00 • —>- С6Н5С (СН3)2 00С (СН3)2 С«Н5.
-о2
При более высоких температурах реакция окисления кумола протекает как цепная вырожденно-разветвленная:
С«Н5С (СНз)2 ООН —> С6Н5С (СНз)2 О + ОН;
С„Н5С (СН3)26 (ОН) +С6Н5СН (СНзЬ—С6Н5С (СНз)2ОН + С6Н5С (СНз)*.
Среди продуктов окисления обнаружен ацетофенон, который образуется как при распаде гидропероксида, так и непосредственно из пероксидных радикалов:
С6Н5С (СНз)гООН —> С6Н5С(СН3)26 —»- С6Н5ССН3;
О
С6Н5С (СНз)аОб —> СвН5ССНз + СНзО-
II
Окисление кумола в водно-щелочных эмульсиях идет с высокими скоростями и высокой селективностью по гидропероксиду. В дальнейшем гидропероксид кумола подвергают кислотному разложению в фенол и ацетон:
H2SO,
С6Н5С (СНз)гООН —СвН5ОН + СН3СОСН3.
Помимо кумола окислению в гидропероксид подвергаются и другие гомологи бензола и алкилнафталины. Так, при окислении я-цимола через стадию разложения промежуточного продукта— гидропероксида я-цимола получают я-крезол. Окисление я-дйизопропилбензола приводит к гидрохинону, а р-изопрО-пилнафталина — соответственно к р-нафтолу:
(СН3)2СНС«Н<СН (СНзЬ
HsSO.
—> НООС(СНз)2С6Н4С (СНз)2ООН -»-
—* НОСвН4ОН + 2СН3СОСНа;
СН(СН3)а _
2 + СН3СОСН3 •

![]()
При каталитическом (на V2O5) окислении нафталина в паровой фазе получается фталевый ангидрид, который используется в производстве алкидных и полиэфирных смол, пластификаторов для поливинилхлорида, для синтеза красителей.
Окисление толуола. Интересным методом производства капролактама является толуольный. Каталитическим (органические соли кобальта или марганца) жидкофазным окислением толуола при 150—170 °С и 1 МПа получают бензойную кислоту. Модификацией способа является проведение окисления толуола кислородом в растворе уксусной кислоты при 70—90 °С в присутствии ацетата кобальта.
Выход бензойной кислоты 85—90 %. Далее бензойную кислоту гидрируют в жидкой фазе над катализатором из благородного металла. Циклогексанкарбоновую кислоту обрабатывают нитрозилсерной кислотой (N0)HS04 и получают капролактам.
Разработан также способ получения фенола с использованием окислительного декарбоксилирования бензойной кислоты при 220—250°С:
С6Н6СООН —^ СвН50Н + С02.
Выход фенола 85 %.
Окисление этилбензола. Жидкофазное окисление этилбензола воздухом в присутствии ацетата марганца можно использовать для получения с высоким выходом ацетофенона при низком выходе бензойной кислоты. Это одна из стадий промышленного способа получения стирола.
Окисление ксилолов. Окисление я-ксилола применяется для получения терефталевой кислоты, которая представляет большой интерес в связи с производством полиэтилентере-фталата. Известно несколько методов получения терефталевой кислоты. Один из них основан на каталитическом окислении n-ксилола под давлением при 140—150 °С в присутствии солей кобальта Или марганца.
Реакция протекает по радикально-цепному механизму. Образующуюся я-толуиловую кислоту этерифицируют метиловым спиртом й доокисляют:
Оэ СНзОН
СН3СвН4СН3 —> НООСС6Н4СООН--* СН3СбН«СООСН3+ Н20;
02 сн3он
СНзС6Н4СООСНз —-* НООССвН4СООСНз--*
— > Н3СООСС6Н4СООСНз.
Разработан одностадийный процесс окисления я-ксилола в терефталевую кислоту по схеме: ¦
СН8СвН8СНз —> НООСНзСвН5СНз —V СНзСвН8СНО —>
> НОООСС»Н4СН3 —* НООССвН4СНз —> НООССвН4СНО —
— >- НООСС6Н4СООН.
Процесс окисления я-ксилола проводят в среде монокарбо-новых кислот в присутствии катализатора — соли переходного металла (Со и Мп) и промотора — бромсодержащей добавки. Окисление я-ксилола проводят в среде уксусной кислоты при 195—205 °С и давлении до 1,5 МПа. Количество вводимых промотора и катализатора — 0,45% (масс.). Выход терефталевой кислоты достигает 94—95 %, а ее чистота 99 %.
Модификацией данного способа является окисление «-ксилола до терефталевой кислоты без применения агрессивных бромсодержащих добавок с использованием кобальтового катализатора и активатора — ацетальдегида, паральдегида (СвН1гОз), метилэтилкетона. Выход терефталевой кислоты достигает 97—98 %.
При окислении ж-ксилола при 160 °С и 1,5—2 МПа в присутствии ацетата марганца и бромида кобальта получают изо-фталевую кислоту. Процесс проводят в растворе уксусной кислоты.
Окисление о-ксилола приводит к получению фталевого ангидрида.
Окисление три- и т е т р а м е т и л б е н з о л о в. При окислении псевдокумола, мезитилена, гемимеллитола получают бензолтрикарбоновые кислоты. Окислением дурола, изодурола и пренитола можно получить тетракарбоновые ароматические кислоты.
В промышленности для указанной цели в основном используют псевдокумол, дурол и мезитилен. Из псевдокумола получают тримеллитовую кислоту(1), а из дурола — пиромелли-товую кислоту(II):
НООС^ НООСч/^/СООН
ноос-®>-соон ноос/ОХсоон
II
Эти кислоты используют в качестве сырья для получения пластификаторов, термостойких полимеров, присадок, эпоксидных смол, красителей.
Окислительный аммонолиз аренов. Окислительный аммонолиз с получением ароматических нитрилов проводят в паровой фазе при 400—550 °С:
АгСНз + NH3 + VaOa —»• ArgN + 3H20
или
2АгСН3 + 3NO —> 2ArCN + ЗНаО + VaNa.
Большой практический интерес представляет реакция получения акрилонитрила окислительным аммонолизом пропилена, выход которого зависит от используемого катализатора (Bi, Р, Mo, Si, Ва, F, V, Fe, Ni, Мп, Те, Sb, Sn, Cl, Си, W) и составляет 53—84 % •
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ,
ОБРАЗУЮЩИЕСЯ ПРИ ПЕРЕРАБОТКЕ НЕФТИ
10.1. ОБЩИЕ СВЕДЕНИЯ
Непредельные соединения встречаются в сырой нефти редко и в незначительных количествах, главным образом высококипящих фракциях. Однако они образуются в процессах переработки нефти и являются важнейшим сырьем для нефтехимического и основного органического синтеза.
Существует две группы процессов получения непредельных соединений из нефти: процессы, в которых они являются побочными продуктами, и специальные, направленные на их максимальную выработку. К первой группе относят термический и каталитический крекинг, риформинг и коксование нефтяных остатков, основное назначение которых — производство топлив и нефтяного кокса. Вторая группа включает пиролиз, полимеризацию низкомолекулярных алкенов, дегидрирование алканов и синтез высших алкенов в присутствии металлорганических катализаторов.
Объемное содержание непредельных соединений в газах жидкофазного термического крекинга (470—520 °С; 2—5 МПа) составляет примерно 10%, в газах пиролиза (670—900°С; 0,1 МПа) 30—50 %. Как следует из данных, приведенных в табл. 10.1, среди алкенов термических процессов преобладают этилен и пропилен; в меньшем количестве присутствуют бутены и бутадиен. Алкены, содержащиеся в газах каталитического крекинга, состоят в основном из пропилена и бутенов.
Таблица 10.1. Объемный состав газов термической и термокаталитической переработки нефтяного сырья, %
| Компоненты |
Термический крекинг |
Коксование | Пиролиз |
Каталити ческий крекниг |
| На | 0,4 |
1-2 | 10 | 1,0—1,5 |
| Ашканы | ||||
| СН4 |
16—20 | 20—30 |
40—45 | 8-12 |
|
CiHe | 19—20 | 16—20 | 6—10 | 8—10 |
| С,Нв | 25—28 |
б—10 | 1—2 | 10—15 |
| ЫЭО-С4Н10 | 5-7 | 3-5 | 1—2 |
20-25 |
| С4Н10 |
9-10 | 10-15 | 1—2 |
8—12 |
| Алкены |
||||
|
с2н4 | 2—3 |
10-15 | 20—30 | 2—3 |
| С3Нв |
9—10 | 20—25 | 12—15 | 10—15 |
| QHs |
9—10 | 10-15 | 1—2 | 15-20 |
| QHe |
1—5 | — | 3—10 | — |
Непредельные углеводороды содержатся также в жидких продуктах термической и каталитической переработки нефти. Так, массовое содержание непредельных соединений в бензине жидкофазного термического крекинга 30—35 %, бензине парофазного крекинга 40—45 %. бензине каталитического крекинга 10 %•
10.2. СВОЙСТВА
Физические свойства. Низшие алкены (Ci—С4) при обычных условиях — газы. Алкены С5—Ci6 — жидкости, более высокомолекулярные алкены — твердые вещества.
Некоторые свойства низших алкенов приведены в табл. 10.2. Из данных по критической температуре видно, что этилен можно превратить в жидкость только при низкой температуре под высоким давлением, другие алкены сжижаются под давлением уже при охлаждении водой.
В промышленных процессах нефтепереработки алкены получаются в смеси с алканами. Их свойства заметно различаются, что используется при разделении смесей и выделении индивидуальных соединений. 1-Алкены нормального строения имеют более низкую температуру кипения и плавления, чем соответствующие алканы, но более высокую плотность и показатель преломления, как это видно на примере пентана и 1-пен-тена (табл. 10.3). Разветвленные алкены имеют значительно-более высокие температуры кипения и плавления, а также более высокую плотность, чем остальные изомеры. цыс-Изомеры алкенов характеризуются более высокой температурой кипения, чем транс-изомеры.
Ацетилен — в обычных условиях газ; конденсируется при —83,8°С, 0,1 МПа; критическая температура 35,5 °С; критическое давление 6,2 МПа. Как и другие газообразные углеводороды, он дает с воздухом и с кислородом взрывоопасные смеси,
Таблица 10.2. Физические свойства газообразных алкенов
| Углеводород | V 'с | Wc |
^кр* | Пределы взрывоопасных объемных концентрации с воздухом, % |
| Этилен | 9,9 | — 103,7 | 5,05 |
3,0—31 |
| Пропилен |
91,8 | -47,7 | 4,56 | 2,2—10,3 |
|
1-Бутен | 146,2 | —6,3 | 3,97 | 1,6-9,4 |
| цис-2-Бутен | 157,0 |
3,7 | 4,10 | 1,6-9,4 |
| траяс-2-Бутеи |
— | 0,9 | — |
1,6-9,4 |
| Изобутилен | 144,7 | -7,0 |
3,95 | 1,8-9,6 |
| Углеводород | р, кг/м3 | V °с | t кип* ^ |
| Пентан | 626,0 | —129 | 36 |
| 1 -Пеитен | 641,0 |
— 165 | 30 |
|
2,3-Диметил-2-бутеи | 708,8 |
—75 | 73 |
|
1-Гевсен | 674,0 |
—140 | 63 |
причем концентрационные пределы распространения пламени очень широки — объемное соотношение воздух : С2Н2 от 1:2,0 до 1:81. Взрывоопасность ацетилена усугубляется его способностью давать с некоторыми металлами (Си, Ag) взрывоопасные соединения — ацетилениды.
Другим технически важным свойством ацетилена является его растворимость в воде и органических веществах, что имеет значение при его получении, хранении и особенно извлечении из разбавленных газовых смесей.
Химические свойства алкенов. Алкены представляют собой весьма реакционноспособные соединения. Ниже приводятся важнейшие реакции., в которые онн вступают.
Присоединение водорода:
RCH = CH2 + H2 Т— RCH2CH3.
Водород присоединяется к алкенам при комнатной температуре в присутствии тонкоизмельченной платины или палладия. Реакция имеет аналитическое значение. Арены в этих условиях яе подвергаются гидрированию, и таким путем можно определить содержание алкенов, например, в крекинг-бензинах.
Аналитическое значение имеют также реакции алкенов с ацетатом ртути (II) и хлоридом серы(1).
Присоединение ацетата ртути:
^C = c/ + Hg(OOCCH3h + СНзОН —->
> С - С +СНзСООН.
1:нзО hgooccHe
Метод позволяет отделить алкены от других углеводородов и выделить их в чистом виде.
Присоединение хлорида серы(1):
/С1 /CHaCHaCl
S = S( + 2СНа = СНа — * S = S(
ЧС1 ^CHaCHaCl
Эта реакция также позволяет количественно выделить алкены из нефтепродуктов.
Окисление и озонирование алкенов. Эти реакции позволяют установить положение двойной связи в олефине по составу образующихся продуктов:
[О]
СНзСООН + НООССН2СН3 0-0
СНзСН = СНСН2СНз
/ \ 1И]
№.] СНзНС^ ^СНСНгСНз —>
О
—> СНзСНО + ОНССНгСНз.
Кроме того, они имеют практическое значение для получения этиленоксида, ацетальдегида и акролеина:
Ag
—> ch2-gh2
СН2 = СН2 —
^ СНзСНО
При окислении смеси пропилена с аммиаком (окислительный аммонолиз) образуется акрилонитрил — важный мономер для синтетического каучука и химических волокон:
СН2 = СНСНз + NH3 + 1, ¦502 —> СН2 = CHCN + ЗН20.
Из промышленных процессов переработки алкенов можно отметить также полимеризацию, дегидрирование, хлорирование и гидрохлорирование, гидратацию, алкилирование, сульфатиро-вание, оксосинтез.
Полимеризация алкенов до низкомолекулярных олигомеров (димеры, тримеры, тетрамеры) представляет собой промышленный метод производства алкенов Се—С15, а также высокооктанового компонента бензина:
HsPO,
4СзНв —»- Ci2H24.
Полимеризация алкенов до высокомолекулярных полимеров дает ценные полимерные материалы — полиэтилен, полипропилен и полиизобутилен:
A1R,-TIC1(
«С2Н4--*¦ [-СН2 - СН2-]„
-СНа — СНСНз
лСзНв
СНз
п изо-С4Н8
СНз
При дегидрировании бутена и изоамиленов образуются 1,3-бутадиен и изопрен — основные мономеры для синтеза каучука:
СН2 = СНСН2СН3 —> СН2 = СНСН = СН2,
-н,
СН2 = СНСН(СНзЬ —¦* СН2 = СНС (СНз) = сн2.
-Н,
Хлорирование и гидрохлорирование этилена и пропилена представляют собой важные способы получения некоторых растворителей и промежуточных продуктов:
сь
->¦ СН2С1СН2С1 —
С12, НгО
СН2 = СНС1.
СН2 =: СН2
СН2С1СН2ОН— СНзСН2С1 —
-HCI
НС1
Гидратация алкенов в присутствии кислых катализаторов приводит к образованию спиртов:
СН2 = СН2 —¦* СН3СН2ОН,
СН3СН=СН2 СНзСН (ОН).СН*.
Алкилирование алкенами разветвленных алканов дает высокооктановое моторное топливо:
HjSO,
С4Нв (СНз)з СН изо-СвН^.
Алкилированием алкенами моноциклических аренов получают алкилбензолы:
AICIj
C„H2n -f- С6Н, > CnH2n+iCeH5.
Алкилбензолы являются ценным сырьем промышленности основного органического синтеза.
При присоединении серной кислоты к высшим алкенам (су л ь ф а т и р о в а н и и) образуются кислые эфиры серной кислоты — алкилсульфаты, применяемые для получения синтетических моющих средств:
СНз (СНа)„ СН = СН2 + H2SO« - >-0S020H
Реакция взаимодействия алкенов с оксидом углерода(II) и водородом в присутствии кобальтового катализатора (оксо-синтез) имеет большое значение для производства альдегидов:
СН2 = СН2 + СО + Н2 —> СНзСН2СНО.
Дальнейшее восстановление альдегидов позволяет получать соответствующие первичные спирты.
Химические свойства алкадиенов. Важнейшей особенностью соединений с сопряженными связями является их более высокая реакционная способность по сравнению с соединениями^ имеющими изолированные двойные связи. Две сопряженные двойные связи в некоторых случаях ведут себя как единая ненасыщенная система; например, при хлорировании 1,4-бутадиена присоединение хлора к сопряженным связям обычно происходит в концевых положениях 1,4, при этом в положении 2—Зг появляется новая двойная связь:
сь
СН2=СНСН = СН2 —* Н2СС1СН = СНСН2С1.
Лишь небольшая часть бутадиена реагирует подобно алке-нам:
С12
СН2=СНСН=СН2 —* Н2СС1СНС1СН = СН2.
Реакция протекает в две стадии с промежуточным образованием аллильного иона:
СН2 = СНСН = СН2
-cr
Н2СС1СН = СН-СН2С1; Н2С = СНСНС1СН2С1.
СН2-СН-СНСН2С1 —1
Специфической реакцией алкадиенов с сопряженными связями является диеновый синтез (реакция Дильса — Аль-дера). Считают, что он лежит в основе образования аренов при. термической переработке алкенов:
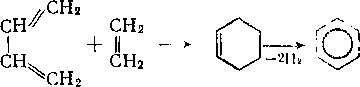
Для количественного определения алкадиенов в нефтепродуктах используется реакция конденсации диенов с ма-
леиновым ангидридом:
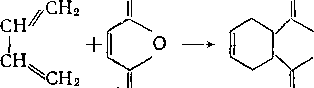
о
о
Очень важной особенностью диенов с сопряженными двойными связями является крайняя легкость их полимеризации. При полимеризации некоторых диенов получаются очень длинные цепи:
яСН2=СНСН = СН2 —> [—СН2СН = СНСН2— ]п.
Реакции этого типа лежат в основе получения синтетического каучука. Наибольшее промышленное значение имеют два алкадиена: 1,3-бутадиен и его гомолог 2-метил-1,3-бутадиен
(изопрен).
Химические свойства алкинов. Алкины, благодаря высокой реакционной способности, вступают в многочисленные химические реакции — полимеризации, присоединения, конденсации и Др.
Полимеризация ацетилена в зависимости от условий протекает различно. При пропускании ацетилена через раствор •CuCl и NH4C1 в соляной кислоте при 80 °С образуется винил-ацетилен:
СН2 = СНСе=СН.
2СН ВВ СН
Эта реакция имеет большое практическое значение. Винил--ацетилен, легко присоединяя НС1, превращается в хлоропрен (мономер СК):
СН2 = СНС = СН + НС1 —> СН2 = CHCC1 = сн2.
Возможна полимеризация ацетилена с образованием циклических соединений (бензола, циклооктатетраена и др.):
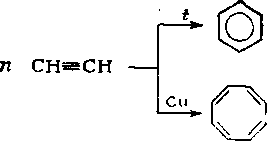
Присоединение галогенов к ацетилену используется для синтеза ряда растворителей:
Гидрохлорированием ацетилена в промышленности получают винилхлорид — мономер, служащий сырьем для изготовления пластических масс:
Hgcij
СН з= СН + НС1 —-> СН2 = СНС1.
При гидратации ацетилена образуется ацетальдегид. Реакция протекает при каталитическом действии солей ртути (была открыта М. Г. Кучеровым и обычно называется его именем) :
СН = СН + НгО ^1- СНзСНО.
Ацетальдегид является сырьем для производства уксусной кислоты, ее эфиров и других ценных продуктов.
Реакции в и н и л и р о в а н и я — присоединения к ацетилену соединений с подвижным атомом водорода — используют как способ получения виниловых эфиров, винилацетата, акрило-нитрила:
ROH
CH2=CHOR
-Сн.соон
> сН2=СНОСОСН3
СН = СН
N - »- СН2=
CHCN.
Винильная группа в продуктах реакции придает им способность к полимеризации, поэтому они используются как мономеры для производства пластических масс. Наибольшее значение имеют простые виниловые эфиры CH2=CHOR, винилаце-тат СНг=СНОСОСНз, акрилонитрил СНг = СНСЫ.
Конденсация с карбонильными соединениями приводит к образованию алкиновых спиртов и гликолей. Таким путем из ацетилена и формальдегида получают пропаргиловый спирт и 1,4-бутиндиол:
нсно нсно
CHsCH -> СНазССНгОН —> НОСН2С = ССН2ОН.
Нитрование ацетилена азотной * кислотой происходит с расщеплением тройной связи и дает тетранитрометан:
СН*аСН +6HNO3 —С (NOa)« + COa +2NOa +4НаО.
10.3. ИСПОЛЬЗОВАНИЕ В НЕФТЕХИМИЧЕСКОМ СИНТЕЗЕ
Наибольшее значение в нефтехимической промышленности имеют четыре углеводорода: этилен, пропилен, бутадиен и бензол. На их основе производят большую часть всех нефтехимических продуктов.
Пропноновый альдегид (нлн кислота)
Прочие продукты
Первое место по масштабам производства и потребления занимает этилен. Основной способ производства этилена — пиролиз углеводородного сырья. Мощность мирового производства этилена в 1980 г. 60 млн. т/год, а в 1995 г. по прогнозам она составит свыше 90 млн. т/год. Структура потребления этилена представлена в табл. 10.4.
В конечной структуре потребления этилена 60—70 % занимают пластмассы (полиэтилен, поливинилхлорид, полистирол). Самый крупный потребитель этилена — производство полиэтилена. Полиэтилен высокого давления (низкой плотности) получают методом радикальной полимеризации при 200—270°С и 100—350 МПа в присутствии инициаторов (кислород, органические пероксиды). Полиэтилен среднего давления получают в присутствии оксидных катализаторов при 130—170 °С и давлении 3,5—4,0 МПа. Для производства полиэтилена низкого давления (высокой плотности) применяют металлорганические катализаторы Циглера при 75—85 °С и давлении 0,2—0,5 МПа.
Значительное количество этилена расходуется на производство этиленоксида. В большинстве развитых стран этиленоксид получают каталитическим окислением этилена. Наиболее распространенный катализатор — серебро на носителе. Основное количество (58 %) этилеиоксида используется в производстве этиленгликоля, применяемого для получения антифризов, полиэфирных волокон и других продуктов. Этиленоксид является также исходным материалом в производстве гликолей большой молекулярной массы, сложных эфиров, этаноламина и поверх-ностно-активных веществ. Гидратацией этилена получают этиловый спирт, который применяется в производстве бутадиена. Однако этот способ менее экономичен по сравнению с производством бутадиена из бутана и бутилена. Перспективным направлением использования этилового спирта является производство белково-витаминных концентратов (БВК).
Оксосиирты J 33,1
Аллнлацетат Глндернн Прочие
Производство пропилена в мире сейчас составляет около 30 млн т/год. Основным способом производства пропилена, как и этилена, является пиролиз.
Масштабы потребления и области применения пропилена непрерывно расширяются. Структура его потребления приведена в табл. 10.5.
Основная часть пропилена направляется на производство полипропилена. Другим важнейшим продуктом, получаемым на основе пропилена, является акрилонитрил — мономер для производства синтетических волокон и каучука. Практически единственным методом его получения служит окислительный аммо-нолиз пропилена.
Пропнленоксид получают хлоргидринным методом:
0,5 Са (ОН),
СНзСН = СН2 + н20 + С1„ -> СНзСН (ОН) CHSC1 ->
-НС I
—> СН2 — СН - СНз + 0,5СаС 12 + Н20.
О
Широко используется способ сопряженного окисления этил-бензола и пропилена. Пропиленокснд применяют в производстве полиуретанов, пропиленглнколя, ПАВ и других областях.
Изопропиловый спирт получают сернокислотной гидратацией пропилена и используют для производства пергидроля, ацетона, вторичных алкилсульфатов, гидротормозной жидкости. Значительное количество пропилена расходуется в производстве бутиловых спиртов, которые используются для получения пластификаторов (дибутилфталат), лаков, красок, растворителей. Масляный альдегид, получаемый из пропилена путем оксоснн-теза, является исходным материалом для производства 2-этил-
гексанола, который в свою очередь используется при получении пластификаторов и синтетических масел.
Алкены С4—С5 получают на пиролизных установках, дегидрированием алканов или выделяют из газов каталитического крекинга. На основе б у тенов производят бутадиен, метил-этилкетон и продукты полимеризации и сополимеризации. Из изобутилена получают бутилкаучук, изопрен, метил-грег-бути-ловый эфир, полиизобутилен, алкилфенольные присадки и ряд других продуктов. П е н т е и ы используют для производства изопрена и амиловых спиртов.
Ал ка диены—1,3-бутадиеи и 2-метил-1,3-бутадиен (изопрен)— важнейшие мономеры для производства различных полимерных материалов, особенно синтетического каучука.
Ниже приведены данные по производству и потреблению 1,3-бутадиена в мире, тыс. т:
|
1981 г. | 1985 г. |
1990 г. |
| 3849 |
4149 | 4666 |
|
3403 | 3829 | 4196 |
| 3690 | 4313 |
5044 |
| 2893 |
3403 | 3970 |
Производство
общее
в том числе из продуктов пиролиза
Потребление общее
в том числе для получения эластомеров
Основные способы производства бутадиена: одно- и двух-стадийное. дегидрирование бутана, дегидрирование бутенов, выделение из .пиролизной фракции С4 и метод Лебедева (на основе этилового спирта). Последний метод устарел, и объем производства по нему сокращается. Наиболее экономичным, по-видимому, является процесс получения бутадиена из пиролизного сырья.
Фракция С4, образующаяся при пиролизе бензина, имеет следующий массовый состав, %: 1,3-бутадиен — 48; изобу-тен — 22; 1-бутен—14; 2-бутен—11. Себестоимость бутадиена, выделенного из газов пиролиза, примерно на 40 % ниже себестоимости бутадиена, получаемого двухстадийным каталитическим дегидрированием бутана. В России пиролизный метод пока не получил широкого распространения, так как основное сырье для него составляют легкие углеводороды и количество бутадиена, извлекаемого из продуктов пиролиза, незначительно. С увеличением молекулярной массы исходных углеводородов выход бутадиена возрастает:
Выход Выход
бутадиена. буталнешь
В связи с тенденцией к утяжелению сырья пиролиза доля пиролизного бутадиена будет увеличиваться.
Перспективными способами получения бутадиена являются также димеризация этилена, диспропорционирование пропилена (в бутилен и этилен), одностадийное окислительное дегидрирование бутана.
Изопрен получают главным образом двухстадийным дегидрированием изопентана, конденсацией изобутилеиа с формальдегидом (реакция Принса), комплексной переработкой фракции С5 пиролиза, содимеризацИей этилена с пропиленом, а также синтезом на основе ацетона и' ацетилена. Высшие алкены (выше С5) являются высокооктановыми компонентами бензина, а также используются в нефтехимическом синтезе — для алкилирования бензола с целью получения моющих веществ, в качестве сырья для оксосинтеза и других целей.